Kalsiyum hidroksit (Ca(OH)2), gıda üretimi, su arıtma ve inşaat gibi çeşitli uygulamalarda kullanılan kimyasal bir bileşiktir. Kalsiyum oksidin suyla karıştırılmasıyla yapılır ve beyaz, tozlu bir görünüme sahiptir.
| IUPAC’ın adı | Kalsiyum hidroksit |
| Moleküler formül | Ca(OH)2 |
| CAS numarası | 1305-62-0 |
| Eş anlamlı | Sönmüş kireç, sönmüş kireç, kireç sütü, salamura kireç |
| InChI | InChI=1S/Ca.2H2O/h;2*1H2/q+2;;/p-2 |
Kalsiyum hidroksitin özellikleri
Kalsiyum Hidroksit Formülü
Kalsiyum hidroksitin kimyasal formülü Ca(OH)2’dir. Bu, her kalsiyum hidroksit molekülünün bir Ca2+ iyonu ve iki OH- iyonu içerdiği anlamına gelir. Formül kimyada önemlidir çünkü bir bileşikteki atomların sayısını ve türlerini temsil eder.
Kalsiyum Hidroksit Molar Kütlesi
Ca(OH)2’nin molar kütlesi 74,09 g/mol’dür. Bir kalsiyum atomu, iki oksijen atomu ve iki hidrojen atomundan oluşur. Molar kütle kimyada önemli bir özelliktir çünkü belirli bir numunedeki bir maddenin miktarını hesaplamak için kullanılır.
Kalsiyum hidroksitin kaynama noktası
Ca(OH)2’nin kaynama noktası 2400°C’dir. Bu, onu sıvıdan gaza dönüştürmek için önemli miktarda ısı gerektiği anlamına gelir. Yüksek kaynama noktası, kalsiyum ve hidroksit iyonları arasındaki güçlü iyonik bağlardan kaynaklanmaktadır.
Kalsiyum Hidroksitin Erime Noktası
Ca(OH)2, 580°C gibi nispeten düşük bir erime noktasına sahiptir. Bu, kolayca eritilebileceği ve farklı şekillerde kalıplanabileceği anlamına gelir. Düşük erime noktası, bileşiğin iyonik doğasından kaynaklanmaktadır, bu da iyonların ısıtıldığında daha serbestçe hareket etmesini sağlar.
Kalsiyum hidroksitin yoğunluğu g/mL
Ca(OH)2’nin yoğunluğu 2,24 g/mL’dir. Bu, yoğunluğu 1 g/mL olan suya kıyasla nispeten ağır bir bileşik olduğu anlamına gelir. Yüksek yoğunluk, Ca2+ ve OH- iyonlarının çok kompakt doğasından kaynaklanmaktadır.
Kalsiyum Hidroksit Molekül Ağırlığı
Ca(OH)2’nin moleküler ağırlığı 74,09 g/mol’dür. Bu, bileşikteki kalsiyum, oksijen ve hidrojen atomlarının atom ağırlıklarının toplamıdır. Moleküler ağırlık, molarite ve bileşim yüzdesi gibi çeşitli parametreleri hesaplamak için kullanıldığından kimyada önemli bir özelliktir.
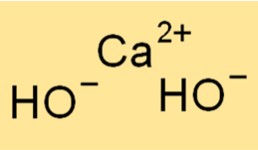
Kalsiyum hidroksitin yapısı
Ca(OH)2, her bir kalsiyum iyonunun oktahedral bir düzende altı hidroksit iyonu ile çevrelendiği bir kristal yapıya sahiptir. Bu yapı bileşiğe karakteristik beyaz ve tozlu görünümünü verir. Ca2+ ve OH- iyonları arasındaki iyonik bağlar güçlüdür, bu da bileşiğe yüksek erime ve kaynama noktaları kazandırır.
| Dış görünüş | Beyaz toz |
| Spesifik yer çekimi | 2,24 g/cm³ |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 74,09 gr/mol |
| Yoğunluk | 2,24 g/cm³ |
| Füzyon noktası | 580°C |
| Kaynama noktası | 2.400°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 1,7 g/L (20°C) |
| çözünürlük | Asitlerde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 12.5 (ilk ayrışma) |
| pH | 12,5 (0,1 M çözelti, 25°C) |
Kalsiyum Hidroksitin Güvenliği ve Tehlikeleri
Ca(OH)2 genellikle doğru kullanıldığında güvenli kabul edilir. Ancak yutulması, solunması veya cilt veya gözlerle teması halinde zararlı olabilir. Bu tahrişe, yanıklara ve solunum problemlerine neden olabilir. Bileşiğin tozu da solunum sistemini tahriş edebilir. Ca(OH)2 ile çalışırken eldiven, gözlük ve solunum cihazı gibi koruyucu ekipmanlar giyilmelidir. Bileşik ayrıca uyumsuz malzemelerden uzakta, serin, kuru ve iyi havalandırılan bir alanda saklanmalıdır. Temas veya yutulması halinde derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Xi (Rahatsız edici) |
| Güvenlik Açıklaması | Koruyucu eldiven ve göz/yüz koruması kullanın. |
| BM kimlik numaraları | 1910 |
| HS kodu | 2825.90.90 |
| Tehlike sınıfı | 8 – Aşındırıcı maddeler |
| Paketleme grubu | III |
| Toksisite | Kalsiyum hidroksitin, doğru şekilde kullanıldığında genellikle toksik olmadığı kabul edilir. Ancak yutulması veya solunması, solunum sistemini ve sindirim sistemini tahriş edebilir ve yakabilir. |
Kalsiyum hidroksit sentezi için yöntemler
Ca(OH)2 çeşitli yöntemlerle sentezlenebilir.
Ca(OH)2’yi sentezlemek için yaygın bir yöntem, suyu kalsiyum oksitle reaksiyona sokarak sönmüş kireç veya sönmüş kireç oluşumuyla sonuçlanmasıdır.
Başka bir yöntem, kalsiyum klorürün sodyum hidroksit ile reaksiyonunu içerir. Su ve karbondioksitin kalsiyum karbonatla reaksiyonu Ca(OH)2 üretir.
Hidrasyon işlemi, sönmüş kireç yöntemi kullanılarak suyun kalsiyum oksitle karıştırılmasını içerir. Bu reaksiyon, yan ürün olarak Ca(OH)2 ve ısı üretir. İşlem ayrıca elde edilen macundaki yabancı maddeleri ve fazla suyu giderir.
Kalsiyum klorür yöntemi, çift ayrışma adı verilen bir işlemde kalsiyum klorür ve sodyum hidroksitin karıştırılmasını içerir.
Bu reaksiyon, yan ürünler olarak Ca(OH)2 ve sodyum klorür üretir. Elde edilen Ca(OH)2 daha sonra saflaştırılır ve kurutulur.
Kalsiyum karbonat yönteminde, kalsiyum karbonat önce ısıtılarak kalsiyum oksit ve karbondioksit üretilir. Hidrasyon işlemi, Ca(OH)2 üreten kalsiyum oksidin suyla karıştırılmasını içerir.
Kalsiyum Hidroksit Kullanım Alanları
Ca(OH)2’nin çeşitli endüstrilerde birçok kullanımı vardır:
- İnşaat: Beton, harç ve sıva üretiminde, bu malzemeleri güçlendirme ve dayanıklılıklarını artırma özelliğinden dolayı anahtar bileşen olarak kullanılır.
- Tarım: Toprak asitliğini azaltmak ve toprak verimliliğini artırmak için toprak düzenleyici olarak kullanılır.
- Su Arıtma: Magnezyum ve kalsiyum iyonları gibi yabancı maddeleri gidererek suyu yumuşatmak için kullanılır.
- Kimyasal üretim: Kalsiyum stearat, kalsiyum hipoklorit ve kalsiyum fosfat gibi çeşitli kimyasalların üretiminde kullanılır.
- Gıda endüstrisi: Turşu, zeytin ve meşrubat gibi gıda ürünlerinde asitlik seviyesini düzenlemek amacıyla gıda katkı maddesi olarak kullanılır.
- Medikal Endüstrisi: Antimikrobiyal ve antifungal özellikleri nedeniyle kanal tedavileri ve kavite dolguları gibi çeşitli diş işlemlerinde kullanılır.
- Kağıt Hamuru ve Kağıt Endüstrisi: Kağıt üretiminde, kağıdın parlaklığını ve mukavemetini arttırmak amacıyla kullanılır.
- Deri endüstrisi: Deri işlemede saçları ve yabancı maddeleri gidermek için kullanılır.
Sorular:
S: Kalsiyum hidroksit çözünür mü?
A: Ca(OH)2, oda sıcaklığında yaklaşık 1,2 g/L’lik bir çözünürlükle suda orta derecede çözünür.
Soru: Kalsiyum hidroksitin formülü nedir?
C: Kalsiyum hidroksitin formülü Ca(OH)2’dir.
S: Yakınımdaki kalsiyum hidroksit nereden satın alınır?
C: Ca(OH)2 kimya mağazalarından, hırdavatçılardan veya çevrimiçi perakendecilerden satın alınabilir. Bölgenizdeki kimya mağazalarını veya hırdavat mağazalarını arayabilir veya Amazon veya eBay gibi çevrimiçi perakendecileri kontrol edebilirsiniz.
Soru: Ca(OH)2 asit mi yoksa baz mı?
Cevap: Ca(OH)2 bir bazdır. Suda tamamen ayrışarak kalsiyum iyonları (Ca2+) ve hidroksit iyonları (OH-) oluşturan güçlü bir bazdır.
Soru: H3PO4(aq)+Ca(OH)2(aq)→ reaksiyonu meydana geldiğinde oluşan tuzun formülü nedir?
C: H3PO4(aq) ve Ca(OH)2(aq) arasındaki reaksiyon, sırasıyla tuz ve yan ürün olarak kalsiyum fosfat (Ca3(PO4)2) ve su (H2O) üretir.
Soru: Ca(OH)2 suda çözünür mü?
C: Evet, Ca(OH)2 suda orta derecede çözünür. Oda sıcaklığında yaklaşık 1,2 g/L konsantrasyonda doymuş bir çözelti oluşturacak şekilde suda çözünebilir.
S: Ca(OH)2 güçlü bir baz mıdır?
C: Evet, Ca(OH)2 güçlü bir bazdır. Suda tamamen ayrışarak Ca2+ ve OH- iyonlarını oluşturan oldukça bazik bir bileşiktir, bu da onu güçlü bir baz yapar.
S: HCl, Ca(OH)2 ile reaksiyona girdiğinde hangileri üretilir?
C: HCl, Ca(OH)2 ile reaksiyona girdiğinde oluşan ürünler kalsiyum klorür (CaCl2) ve sudur (H2O), çünkü HCl’nin H+ iyonları, Ca(OH)2’nin OH- iyonlarıyla reaksiyona girerek su oluşturur. geri kalan Ca2+ ve Cl- iyonları kalsiyum klorür tuzunu oluşturur.
