Kalsiyum fosfat (Ca3(PO4)2) dişlerde ve kemiklerde bulunan bir mineraldir. Bu onların güçlü ve sağlıklı olmalarına yardımcı olur. Kalsiyum eksikliğini önlemek için besin takviyesi olarak da kullanılır.
| IUPAC Adı | Kalsiyum fosfat |
| Moleküler formül | Ca3(PO4)2 |
| CAS numarası | 7758-87-4 |
| Eş anlamlı | Trikalsiyum fosfat, kemik fosfat, kalsiyum ortofosfat, tribazik kalsiyum fosfat, TCP |
| InChI | InChI=1S/3Ca.2H3O4P/c;;;2 1-5(2,3)4/h;;;2 (H3,1,2,3,4)/q3*+2;;/p-6 |
Kalsiyum fosfatın özellikleri
Kalsiyum Fosfat Formülü
Kalsiyum fosfatın kimyasal formülü Ca3(PO4)2’dir; bu da onun üç kalsiyum iyonu ve iki fosfat iyonu içerdiğini gösterir. Formül, kimyasal reaksiyonlar için gerekli kalsiyum fosfat miktarını hesaplamak için kullanılır. Kalsiyum fosfat dişlerin ve kemiklerin önemli bir bileşenidir ve ayrıca gıda katkı maddeleri ve gübreler gibi çeşitli endüstriyel uygulamalarda da kullanılır.
Kalsiyum Fosfat Molar Kütlesi
Ca3(PO4)2’nin molar kütlesi 310,18 g/mol’dür. Sırasıyla 40,08 g/mol, 30,97 g/mol ve 15,99 g/mol olan kalsiyum, fosfor ve oksijenin atomik kütlesinin eklenmesiyle hesaplanır. Molar kütle, bir kimyasal reaksiyonda ihtiyaç duyulan Ca3(PO4)2 miktarının belirlenmesinde önemli bir parametredir.
Kalsiyum fosfatın kaynama noktası
Ca3(PO4)2 kaynama noktasına ulaşmadan ayrıştığı için kesin bir kaynama noktası yoktur. Ca3(PO4)2 ısıtıldığında kalsiyum oksit ve fosfor pentoksite ayrışır ve su buharı açığa çıkar. Ayrışma sıcaklığı Ca3(PO4)2 tipine ve ısıtma hızına bağlıdır.
Kalsiyum Fosfatın Erime Noktası
Ca3(PO4)2’nin erime noktası Ca3(PO4)2’nin türüne bağlıdır. Doğada Ca3(PO4)2’nin en bol bulunan formu olan trikalsiyum fosfatın erime noktası yaklaşık 1670°C’dir. Dikalsiyum fosfatın erime noktası yaklaşık 1400°C iken monokalsiyum fosfatın erime noktası yaklaşık 109°C’dir.
Kalsiyum fosfat yoğunluğu g/mL
Ca3(PO4)2’nin yoğunluğu Ca3(PO4)2’nin türüne göre değişir. Trikalsiyum fosfatın yoğunluğu yaklaşık 3,14 g/mL iken dikalsiyum fosfatın yoğunluğu yaklaşık 2,31 g/mL’dir. Monokalsiyum fosfatın yoğunluğu yaklaşık 2,22 g/mL’dir.
Kalsiyum Fosfat Molekül Ağırlığı
Ca3(PO4)2’nin moleküler ağırlığı 310,18 g/mol’dür; bu, kalsiyum, fosfor ve oksijenin atom ağırlıklarının toplamına karşılık gelir. Molekül ağırlığı, kimyasal reaksiyonlar için gerekli Ca3(PO4)2 miktarının hesaplanmasında önemlidir.
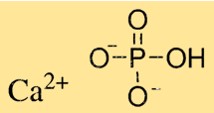
Kalsiyum fosfatın yapısı
Ca3(PO4)2, Ca3(PO4)2’nin türüne bağlı olarak karmaşık bir kristal yapıya sahiptir. Trikalsiyum fosfat altıgen bir kristal yapıya sahipken, dikalsiyum fosfat monoklinik bir kristal yapıya sahiptir. Monokalsiyum fosfat tetragonal bir kristal yapıya sahiptir. Ca3(PO4)2 kristalleri belirli bir düzende düzenlenmiş kalsiyum iyonları ve fosfat iyonlarından oluşur.
| Dış görünüş | Beyaz toz veya kristaller |
| Spesifik yer çekimi | 3.14 |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 310,18 gr/mol |
| Yoğunluk | 3,14 g/mL (trikalsiyum fosfat) |
| Füzyon noktası | 1670 °C (trikalsiyum fosfat) |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Yok |
| sudaki çözünürlük | 0,002 g/100 ml (25°C’de) |
| çözünürlük | Asitlerde çözünür, suda çözünmez |
| Buhar basıncı | Yok |
| Buhar yoğunluğu | Yok |
| pKa | pKa1: 1,9, pKa2: 6,7, pKa3: 12,0 |
| pH | 5,5-7,5 (suda %10 süspansiyon) |
Kalsiyum Fosfatın Güvenliği ve Tehlikeleri
Ca3(PO4)2 genellikle insan tüketimi için güvenli kabul edilir ve önemli bir sağlık riski oluşturmaz. Kemiklerde ve dişlerde bulunan ve birçok formda besin takviyesi olarak kullanılan doğal bir mineraldir. Ca3(PO4)2 aynı zamanda gıda endüstrisinde gıda katkı maddesi ve hamur kıvamlandırıcı olarak da kullanılmaktadır. Ancak Ca3(PO4)2 takviyelerinin aşırı tüketimi mide rahatsızlığı, kabızlık ve hatta böbrek hasarı gibi olumsuz etkilere yol açabilir. Ayrıca iş yerinde yüksek düzeyde Ca3(PO4)2 tozuna maruz kalmak solunum sorunlarına neden olabilir. Bu nedenle Ca3(PO4)2 takviyelerini ve ürünlerini ölçülü kullanmak ve endüstriyel güvenlik kurallarına uymak önemlidir.
| Tehlike sembolleri | Bilinmiyor |
| Güvenlik Açıklaması | 26-36/37/39: Uygun koruyucu kıyafet, eldiven ve göz/yüz koruması kullanın. |
| BM kimlik numaraları | Yok |
| HS kodu | 28352500 |
| Tehlike sınıfı | sınıflandırılmamış |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite |
Kalsiyum fosfat sentez yöntemleri
Ca3(PO4)2 sentezi için çökeltme, hidrotermal sentez, sol-jel işlemi ve katı hal reaksiyonu dahil olmak üzere çeşitli yöntemler vardır.
Çökeltme yöntemi, kalsiyum ve fosfat iyonlarının sulu bir çözelti içinde birleştirilmesini ve bunun sonucunda kimyasal reaksiyon yoluyla bir çökeltinin oluşmasını içerir. Deneyi yapan kişi daha sonra istenen Ca3(P04)2 bileşiğini elde etmek için çökeltiyi yıkar ve kurutur.
Hidrotermal sentez, kalsiyum ve fosfat kaynaklarının yüksek basınç ve yüksek sıcaklık ortamında reaksiyonunu içerir. İstenilen Ca3(PO4)2 bileşiğini elde etmek için elde edilen ürün yıkanır ve kurutulur.
Sol-jel işleminde, bir sol veya kolloidal süspansiyon, bir jele dönüştürülür ve daha sonra kurutularak arzu edilen Ca3(PO4)2 bileşiği elde edilir. Bu yöntem, elde edilen bileşiğin bileşiminin ve morfolojisinin hassas şekilde kontrol edilmesini sağlar.
Katı hal reaksiyonu, kalsiyum pirofosfat ve kalsiyum karbonatın katı halde karıştırılmasını ve ardından karışımın kimyasal bir reaksiyonu teşvik etmek için ısıtılmasını içerir. İstenilen Ca3(PO4)2 bileşiğini elde etmek için elde edilen ürünün yıkanması ve kurutulması gerekir.
Kalsiyum Fosfatın Kullanım Alanları
Ca3(PO4)2 benzersiz özelliklerinden dolayı farklı endüstrilerde birçok kullanıma sahiptir. Ca3(PO4)2’nin yaygın kullanımlarından bazıları şunlardır:
- Diyet Takviyeleri: Kemik sağlığı için gerekli mineraller olan kalsiyum ve fosfor kaynağı olarak diyet takviyelerinde yaygın olarak kullanılır.
- Yiyecek ve İçecek Endüstrisi: Unlu mamuller, süt ürünleri ve içecekler dahil olmak üzere birçok işlenmiş gıdada gıda katkı maddesi olarak kullanılır. Pişirmede insanlar bunu bir ayrılma maddesi ve kalsiyum kaynağı olarak kullanırlar.
- İlaç Endüstrisi: İlaç endüstrisinde tablet ve kapsüllerde dolgu ve bağlayıcı olarak kullanılır. Bazı ilaçların biyoyararlanımları kaplama maddesi olarak kullanılarak geliştirilebilir.
- Tarım: Bitkilere kalsiyum ve fosfor gibi temel besinleri sağlamak için gübre olarak kullanılır.
- Diş Hekimliği: Diş hekimliğinde dişleri yeniden mineralleştirmek ve diş minesini onarmak için kullanılır.
- Biyomedikal Mühendisliği: Ayrıca biyomedikal mühendisliğinde kemik grefti ikame maddeleri geliştirmek ve kemik dokusu mühendisliğinde kullanılan biyomateryallerin özelliklerini geliştirmek için kullanılır.
Sorular:
S: Asit eklemek neden kalsiyum fosfatın çözünürlüğünü artırır?
C: Asit eklemek, fosfat iyonlarını protonlayarak Ca3(PO4)2’nin çözünürlüğünü artırır, böylece suda daha çözünür hale gelir. Protonlanmış fosfat iyonları, nötr formdan daha fazla çözünür olan asidik Ca3(PO4)2 oluşturur.
Soru: 500,0 gram kalsiyum fosfatta kaç gram fosfor bulunur?
C: Ca3(PO4)2’nin molar kütlesi 310,18 g/mol’dür. Bileşiğin fosfor/kalsiyum oranı 2:3’tür, dolayısıyla fosforun molar kütlesi 30,97 g/mol’dür. Dolayısıyla 500,0 gram Ca3(PO4)2’de 81,62 gram fosfor bulunur.
S: Kalsiyum fosfat çözünür mü?
C: Ca3(PO4)2’nin suda çözünürlüğü düşüktür ve ürün çözünürlüğü 1,8 x 10^-29’dur. Ancak asit ilavesiyle çözünürlüğü arttırılabilir.
Soru: Kalsiyum fosfattaki oksijenin kütlece yüzdesi nedir?
C: Ca3(PO4)2’nin molar kütlesi 310,18 g/mol’dür. Oksijenin atom kütlesi 16,00 g/mol’dür ve bir mol Ca3(PO4)2’de 8 oksijen atomu vardır. Dolayısıyla bir mol Ca3(PO4)2’deki oksijenin kütlesi 8 x 16,00 = 128,00 g’dır. Ca3(PO4)2’nin kütlesi 310,18 g’dır, dolayısıyla kütlece oksijen yüzdesi (128,00 g / 310,18 g) x %100 = %41,23’tür.
S: Ca3(PO4)2 suda çözünür mü?
C: Ca3(PO4)2 suda çok fazla çözünmez ve ürün çözünürlüğü 1,3 x 10^-33’tür.
S: Ca3(PO4)2’nin molar kütlesi nedir?
C: Ca3(PO4)2’nin molar kütlesi 310,18 g/mol’dür.
S: Ca3(PO4)2 nedir?
C: Ca3(PO4)2, üç Ca2+ iyonu ve iki PO43- iyonundan oluşan kimyasal bir bileşiktir. Beyaz bir tozdur, kokusuzdur ve suda çözünmez.
Soru: Ca3(PO4)2’nin gram cinsinden kütlesi nedir?
A: Ca3(PO4)2’nin gram cinsinden formül kütlesi 310,18 g/mol’dür.
