Magnezyum iyodür, MgI2 formülüne sahip kimyasal bir bileşiktir. Suda ve alkolde yüksek oranda çözünür, beyaz kristal bir katıdır. MgI2, organik sentez reaksiyonlarında yaygın olarak iyot kaynağı olarak kullanılır.
| IUPAC’ın adı | Magnezyum iyodür |
| Moleküler formül | MgI2 |
| CAS numarası | 10377-58-9 |
| Eş anlamlı | Magnezyum Diiyodür, Magnezyum(II) İyodür, UNII-14R347R70C |
| InChI | InChI=1S/2HI.Mg/h2*1H;/q;;+2/p-2 |
Magnezyum iyodürün özellikleri
Magnezyum İyodür Formülü
Magnezyum iyodürün kimyasal formülü MgI2’dir. Bu formül, bir magnezyum iyodür molekülünün bir Mg2+ katyonu ve iki I-anyonundan oluştuğunu gösterir. Magnezyum iyodür formülü, kimyasal reaksiyonların stokiyometrisinin belirlenmesinde ve bileşiğin dahil olduğu kimyasal reaksiyonların ürünlerinin tahmin edilmesinde faydalıdır.
Magnezyum İyodür Molar Kütlesi
MgI2’nin molar kütlesi 278.113 g/mol’dür. Bu değer, bir MgI2 molekülünde bulunan iki I atomunun (253.808 g/mol) atom kütlesine bir Mg atomunun (24.305 g/mol) atom kütlesinin eklenmesiyle elde edilir. MgI2’nin molar kütlesi, bileşiğin belirli bir miktarının kütlesini belirlemek için önemli bir parametredir ve birçok endüstriyel ve bilimsel uygulamada faydalıdır.
Magnezyum iyodürün kaynama noktası
MgI2’nin kaynama noktası 1309°C’dir. Bu, bileşikteki Mg ve I atomları arasındaki moleküller arası çekim kuvvetlerini kırmak için önemli miktarda enerjinin gerekli olduğunu gösterir. MgI2’nin kaynama noktası, onu yarı iletkenlerin ve diğer elektronik bileşenlerin imalatı gibi yüksek sıcaklık uygulamalarına uygun hale getirir.
Magnezyum İyodür Erime Noktası
MgI2’nin erime noktası 637°C’dir. Bu sıcaklıkta katı MgI2 sıvı duruma dönüşür. MgI2’nin erime noktası, onun çeşitli uygulamalara uygunluğunu belirleyen önemli bir fiziksel özelliktir. Örneğin, yüksek erime noktası, MgI2’yi, homojen bir karışım oluşturmak için metallerin birlikte eritilmesinin gerekli olduğu alüminyum alaşımlarının üretiminde eritken olarak kullanım için ideal kılar.
Magnezyum iyodür yoğunluğu g/mL
MgI2’nin yoğunluğu 4,43 g/mL’dir. Bu değer, belirli bir uzay hacminde bulunan bileşiğin kütlesini gösterir. MgI2’nin yoğunluğu, belirli bir uygulama için gereken bileşik miktarının belirlenmesinde dikkate alınması gereken önemli bir faktördür. MgI2’nin yüksek yoğunluğu onu nükleer reaktörlerde koruyucu malzeme olarak da kullanışlı kılar.
Magnezyum İyodür Molekül Ağırlığı
MgI2’nin moleküler ağırlığı 278.113 g/mol’dür. Bu değer, bileşiği oluşturan elementler olan Mg ve I’in atom ağırlıklarının toplamıdır. MgI2’nin moleküler ağırlığı, kimyasal reaksiyonların stokiyometrisinin hesaplanmasında ve belirli bir numunede bulunan bileşiğin mol sayısının belirlenmesinde faydalıdır.
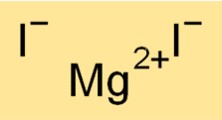
Magnezyum iyodürün yapısı
MgI2 altıgen kristal sistemine ait bir kristal yapıya sahiptir. Yapı, altıgen bir kafes halinde düzenlenmiş magnezyum katyonları ve iyodür anyonlarından oluşur. Mg2+ katyonları altıgen hücrelerin merkezini işgal ederken, I-anyonları hücrelerin köşelerini işgal eder. MgI2’nin kristal yapısı, yüksek erime ve kaynama noktaları gibi fiziksel ve kimyasal özelliklerine katkıda bulunur.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 4,43 gr/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 278.113 gr/mol |
| Yoğunluk | 4,43 gr/ml |
| Füzyon noktası | 637°C |
| Kaynama noktası | 1.309°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Alkol, asetonda çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Magnezyum iyodürün güvenliği ve tehlikeleri
MgI2, doğru şekilde kullanıldığında ve kullanıldığında genellikle güvenli kabul edilir. Bununla birlikte, herhangi bir kimyasal bileşik gibi, dikkatli bir şekilde kullanılmazsa belirli tehlikelere yol açabilir. MgI2 cilt ve göz tahriş edici olarak sınıflandırılır ve bileşiğe uzun süre maruz kalmak ciltte hassasiyete veya solunum yolu tahrişine neden olabilir. MgI2 ile çalışırken eldiven, göz koruması ve gerekirse solunum cihazı dahil uygun kişisel koruyucu ekipmanın kullanılması önemlidir. Ek olarak MgI2 suyla şiddetli reaksiyona girerek yanıcı hidrojen gazı açığa çıkarabilir. Bu nedenle nem kaynaklarından uzakta saklanmalı ve kullanılmalıdır.
| Tehlike sembolleri | Xi: Sinir bozucu |
| Güvenlik Açıklaması | S22: Tozu solumayın. S24: Cilt ile temasından kaçının. S36/37/39: Uygun koruyucu kıyafet, eldiven ve göz/yüz koruması kullanın. |
| BM kimlik numaraları | UN3077 |
| HS kodu | 28276000 |
| Tehlike sınıfı | 9: Çeşitli tehlikeli mallar |
| Paketleme grubu | III |
| Toksisite | Düşük toksisite |
Magnezyum iyodür sentez yöntemleri
MgI2’yi sentezlemek için her birinin avantajları ve sınırlamaları olan çeşitli yöntemler vardır.
Yaygın bir yöntem, magnezyum metalinin susuz bir eter veya tetrahidrofuran (THF) solventi içerisinde iyot ile reaksiyonunu içerir. Bu reaksiyon beyaz bir katı çökelti formunda MgI2 üretir.
Başka bir yöntem, magnezyum oksit veya magnezyum hidroksitin hidriyodik asit ile reaksiyonunu içerir. Bu yöntem genellikle MgI2 üretmek için magnezyum oksit veya hidroksitin hidroiyodik asitle ısıtılmasını içerir.
Magnezyum karbonat veya magnezyum oksidin hidrojen iyodür gazı ile reaksiyonu da MgI2 üretir. Bu reaksiyon genellikle yüksek sıcaklıklarda meydana gelir ve beyaz bir katı ürün olarak MgI2 üretir.
Genel olarak MgI2 sentez yönteminin seçimi, nihai ürünün arzu edilen saflığı, ham maddelerin mevcudiyeti ve sentezin gerçekleştirileceği koşullar gibi faktörlere bağlı olacaktır.
Magnezyum İyodürün Kullanım Alanları
MgI2 benzersiz özelliklerinden dolayı farklı alanlarda birçok kullanıma sahiptir. MgI2’nin bazı yaygın uygulamaları şunlardır:
- Katalizör olarak: Organik kimyasal reaksiyonlarda, özellikle karbon-karbon bağlarının oluşumunda katalizör olarak kullanılır.
- Grignard reaktiflerinin hazırlanmasında: Grignard reaktiflerinin hazırlanmasında kullanılır. Organik kimyacılar çok çeşitli organik bileşikleri sentezlemek için Grignard reaktiflerini kullanır.
- Tıbbi olarak: Vücuda sağlıklı vücut fonksiyonlarının sürdürülmesi için önemli olan temel magnezyum ve iyotu sağlamak için tıbbi olarak takviye olarak kullanılır.
- Nükleer reaktörlerde: nükleer reaktörlerde fisyon reaksiyonlarının hızını kontrol etmek için nötron emici olarak kullanılır.
- Fotoğraf işleme: fotoğraf filmlerinin oksidasyonunu ve bozulmasını önlemek için fotoğraf işlemede stabilizasyon maddesi olarak kullanılır.
- Magnezyum metali üretiminde: Farklı endüstrilerde geniş bir uygulama alanına sahip olan magnezyum metali üretiminde de öncü olarak kullanılır.
Sorular:
S: MgI2 ne tür bir çözünmeye uğrar?
C: MgI2, iyonik bir bileşik olması nedeniyle iyonik çözünmeye uğrayacaktır.
S: Magnezyum iyodürün kimyasal formülü nedir?
C: Magnezyum iyodürün kimyasal formülü MgI2’dir.
S: MgI2 çözünür mü?
C: Evet, MgI2 su, alkol ve eterde çözünür.
S: Magnezyum iyodürün formülü nedir?
C: Magnezyum iyodürün formülü MgI2’dir.
S: MgI2 ne tür bir bileşiktir?
A: MgI2, iki elektronun magnezyumdan iyodine aktarılmasıyla oluşan iyonik bir bileşiktir.
S: MgI2 kimyasal formülüne sahip bileşik hangisidir?
C: MgI2 kimyasal formülüne sahip bileşik magnezyum iyodürdür.
Soru: MgI2 formülüne sahip bileşiğin adı nedir?
C: MgI2 formülüne sahip bileşiğin adı Magnezyum İyodür’dür.
