Potasyum bromür (KBr), potasyum ve bromdan oluşan kimyasal bir bileşiktir. Köpeklerde antikonvülsan olarak fotoğrafçılıkta, tıpta ve veteriner hekimliğinde yaygın olarak kullanılır.
| IUPAC Adı | Potasyum bromit |
| Moleküler formül | KBr |
| CAS numarası | 7758-02-3 |
| Eş anlamlı | Potasyum Bromür, Potasyum Bromür Tuzu, Kaliobromid, Bromopotasyum |
| InChI | InChI=1S/BrH.K/h1H;/q;+1/p-1 |
Potasyum bromürün özellikleri
Potasyum Bromür Formülü
Potasyum bromürün kimyasal formülü KBr’dir. Bu formül bileşikteki atomların oranını temsil eder. K+ iyonunun yükü +1, Bri- iyonunun yükü ise -1 olup nötr bir bileşik elde edilir. Formül, bileşiğin bileşimini belirtmek için kullanılır ve dengeli kimyasal denklemlerin yazılması için gereklidir.
Potasyum Bromür Molar Kütlesi
KBr’nin molar kütlesi 119,01 g/mol’dür. Bir potasyum atomu ve bir brom atomundan oluşur. Molar kütle bir bileşiğin önemli bir özelliğidir çünkü belirli bir numunedeki bir maddenin mol sayısını belirlemek için kullanılır. Ayrıca stokiyometride bir kimyasal reaksiyondaki bir ürünün veya reaktanın kütlesini hesaplamak için de kullanılır.
Potasyum bromürün kaynama noktası
KBr’nin kaynama noktası 1.390 °C’dir (2.534 °F). Bu yüksek kaynama noktası bileşiğin iyonik yapısından kaynaklanmaktadır. Isıtıldığında, potasyum ve brom arasındaki iyonik bağların kırılması için büyük miktarda enerji gerekir, bu da yüksek kaynama noktasına neden olur. KBr, yüksek kaynama noktasından dolayı laboratuvarda ısı transfer akışkanı olarak yaygın olarak kullanılır.
Potasyum bromür Erime noktası
KBr’nin erime noktası 734°C’dir (1,353°F). Kaynama noktası gibi erime noktası da potasyum ve brom atomları arasındaki iyonik bağların kuvvetiyle belirlenir. Isıtıldığında iyonik bağlar zayıflar ve bileşiğin kristal kafes yapısı bozularak sıvı hale gelir.
Potasyum bromürün yoğunluğu g/mL
KBr’nin yoğunluğu oda sıcaklığında 2,75 g/mL’dir. Bir maddenin yoğunluğu, birim hacim başına maddenin kütlesi olarak tanımlanır. KBr’nin yüksek yoğunluğu, bileşiğin sıkı kristal yapısından kaynaklanmaktadır. Bu özellik onu mercekler ve prizmalar gibi optik malzemelerin yapımında faydalı kılar.
Potasyum Bromür Molekül Ağırlığı
KBr’nin moleküler ağırlığı 119,01 g/mol’dür. Bu değer, potasyum ve bromun atom kütlelerinin eklenmesiyle hesaplanır. Molekül ağırlığı, belirli bir konsantrasyonda bir çözelti hazırlamak için gereken madde miktarının belirlenmesi gibi kimyasal hesaplamalarda kullanılır.
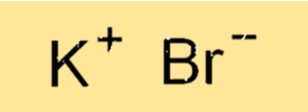
Potasyum bromürün yapısı
KBr, yüz merkezli kübik kafesten oluşan bir kristal yapıya sahiptir. Her K+ iyonu altı Br- iyonuyla, her Bri- iyonu ise altı K+ iyonuyla çevrilidir. Bu düzenleme, kristal yapısında düzenli, tekrarlanan iyon düzenlemesine sahip olan iyonik bileşiklerin karakteristiğidir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 25°C’de 2,75 g/mL |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 119,01 gr/mol |
| Yoğunluk | 2,75 g/cm³ |
| Füzyon noktası | 734°C (1.353°F) |
| Kaynama noktası | 1390°C (2534°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 53 g/100 mL |
| çözünürlük | Alkol, aseton ve amonyakta çözünür |
| Buhar basıncı | 1114°C’de 1 mmHg |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 7,5 (25°C’de) |
| pH | 7 (nötr) |
Potasyum bromürün güvenliği ve tehlikeleri
KBr’nin kullanımı genellikle güvenli kabul edilir, ancak yanlış kullanıldığında bazı tehlikelere yol açabilir. Cildi, gözü ve solunumu tahriş edicidir ve yutulması gastrointestinal rahatsızlığa neden olabilir. Yüksek konsantrasyonlara uzun süre maruz kalmak solunum problemlerine neden olabilir. KBr dikkatle kullanılmalı ve bileşiğin taşınması sırasında eldiven ve toz maskesi dahil uygun kişisel koruyucu ekipman giyilmelidir. KBr’nin serin, kuru ve iyi havalandırılmış bir alanda uyumsuz malzemelerden uzakta saklanması da önemlidir. Maruz kalma durumunda derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Xi – Sinir bozucu |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. Uygun koruyucu kıyafet, eldiven ve gözlük/yüz siperi kullanın |
| koruma. | |
| BM kimlik numaraları | UN 1465 (Kimyasallar, potasyum bromür) |
| HS kodu | 28275100 |
| Tehlike sınıfı | 6.1 (Zehirli maddeler) |
| Paketleme grubu | III |
| Toksisite | LD50 (oral, sıçan) = 2,340 mg/kg |
Potasyum bromürün sentezi için yöntemler
KBr’yi sentezlemek için doğrudan sentez, çift ayrıştırma ve asit-baz titrasyonu gibi çeşitli yöntemler kullanılabilir.
KOH, doğrudan sentezde KBr üretmek için HBr gazıyla reaksiyona girer. Reaksiyon yan ürün olarak KBr ve su üretir.
Çift ayrışma, çözünür bir potasyum tuzunun, potasyum klorür ve sodyum bromür gibi çözünür bir bromür tuzu ile reaksiyonunu içerir. Reaksiyon KBr ve sodyum klorür üretir.
Asit-baz titrasyonu, bir bromür tuzunun KOH ile reaksiyonunu içerir. Seyreltik sülfürik asit önce bromür tuzunu işleyerek Hbr’yi oluşturur, ardından KOH başlığını KBr ve su üretir.
KBr’yi sentezlemenin başka bir yöntemi, bromun sıcak bir potasyum hidroksit çözeltisi ile reaksiyona sokulmasını içerir. Sodyum sülfit, potasyum bromat’ı azaltarak KBr ve potasyum bromat üretir.
Potasyum Bromürün Kullanım Alanları
KBr, benzersiz özellikleri nedeniyle çeşitli endüstrilerde çeşitli kullanımlara sahiptir. KBr’nin yaygın kullanımlarından bazıları şunlardır:
- Fotoğrafçılık: Fotoğraf kağıdının buğulanmasını önlemek için siyah beyaz fotoğrafçılıkta fotoğraf sabitleyici olarak yaygın olarak kullanılır.
- Veterinerlik: Nöbet geçiren köpek ve kedilerde antikonvülsan ilaç olarak kullanılır.
- Analitik Kimya: Organik bileşikleri tanımlamak için Fourier Dönüşümü Kızılötesi Spektroskopisinde (FTIR) referans standart olarak kullanılır.
- Tıbbi Kimya: Sedatifler, hipnotikler ve antiepileptikler dahil olmak üzere çeşitli farmasötiklerin hazırlanmasında kullanılır.
- Petrol sondajı: Petrol sondajında formasyon suyunun içeri girmesini önlemek ve korozyon riskini azaltmak için tamamlama sıvısı olarak kullanılır.
- Alev geciktiriciler: Plastik, tekstil ve kağıt ürünlerinde alev geciktirici olarak kullanılır.
- Kimyasal sentez: Ayrıca kimyasal sentez reaksiyonlarında, özellikle çeşitli organik ve inorganik bileşiklerin sentezinde kullanılır.
Sorular:
Soru: Potasyum bromür hangi koşullar altında elektriği iletebilir?
C: KBr erimiş haldeyken veya suda çözündüğünde elektriği iletebilir, iyonlarının serbestçe hareket etmesine ve elektrik yükü taşımasına olanak tanır.
S: KBr iyonik mi yoksa kovalent mi?
A: KBr, elektronların potasyumdan broma aktarılmasıyla oluşan iyonik bir bileşiktir.
S: KBr suda çözünür mü?
C: Evet, KBr suda oldukça çözünür ve 25°C’de 53,5 g/100 mL’lik bir çözünürlüğe sahiptir.
S: Potasyum bromürün formülü nedir?
C: Potasyum bromürün kimyasal formülü KBr’dir.
S: KBr asit mi yoksa baz mı?
C: KBr bir tuzdur ve asidik veya bazik özellikleri yoktur.
S: KBr nedir?
C: KBr, benzersiz özellikleri nedeniyle çeşitli endüstrilerde kullanılan iyonik bir bileşik olan potasyum bromürün kimyasal sembolüdür.
S: 250,0 mL 1,50 M KBr çözeltisi hazırlamak için ne kadar KBr kütlesine (gram cinsinden) ihtiyacınız var?
C: 250,0 ml suda 1,50 M KBr’lik bir çözelti hazırlamak için 30,4 gram KBr’yi suda çözmeniz gerekir.
