Benzen veya C6H6, tatlı bir kokuya sahip, renksiz, oldukça yanıcı bir sıvıdır. Plastik, sentetik elyaf, kauçuk, böcek ilacı ve diğer kimyasalların üretiminde kullanılır. Bilinen bir kanserojendir ve sağlık sorunlarına neden olabilir.
| IUPAC’ın adı | Benzen |
| Moleküler formül | C6H6 |
| CAS numarası | 71-43-2 |
| Eş anlamlı | Benzol, Fenen, Annulene, Sikloheksatrien vb. |
| InChI | InChI=1S/C6H6/c1-2-4-6-5-3-1/h1-6H |
Benzenin özellikleri
Benzenin molar kütlesi
Benzenin molar kütlesi 78,11 g/mol’dür. Altı karbon atomu ve altı hidrojen atomundan oluşan siklik bir organik bileşiktir. Benzenin molar kütlesi, onu oluşturan atomların atomik kütlelerinin eklenmesiyle hesaplanır; bunlar karbon için 12,01 g/mol ve hidrojen için 1,01 g/mol’dür. Benzen, kimya endüstrisinde birçok önemli bileşiğin üretiminde hammadde olarak yaygın olarak kullanılmaktadır. Benzenin molar kütlesi, reaksiyonlar ve diğer uygulamalar için gereken bileşik miktarının belirlenmesinde önemlidir.
Benzen formülü
Benzenin kimyasal formülü C6H6’dır. Bu formül, molekülde bulunan atomların sayısını ve türünü temsil eder. Benzenin formülü, fiziksel ve kimyasal özelliklerinin yanı sıra kimyasal reaksiyonlardaki reaktivitesinin belirlenmesinde önemlidir. Benzen formülü aynı zamanda kimyasal literatür ve düzenleyici belgeler gibi çeşitli bağlamlarda bileşiği adlandırmak ve tanımlamak için de kullanılır.
benzenin kaynama noktası
Benzenin kaynama noktası 80,1°C veya 176,2°F’dir. Bu, benzer molekül ağırlığına sahip diğer organik bileşiklerle karşılaştırıldığında nispeten düşüktür. C6H6’nın kaynama noktası moleküller arası çekim kuvvetlerinden, özellikle de Van der Waals kuvvetlerinden kaynaklanmaktadır. Sıcaklık arttıkça moleküllerin kinetik enerjisi de artar ve sonuçta bu moleküller arası kuvvetlerin parçalanması ve sıvı fazdan gaz fazına geçiş meydana gelir. C6H6’nın düşük kaynama noktası, bileşiğin buharlaştırma yoluyla uzaklaştırılmasının gerekli olduğu uygulamalarda onu faydalı kılar.
Benzenin erime noktası
C6H6’nın erime noktası 5,5°C veya 41,9°F’dir. Bu, benzer molekül ağırlığına sahip diğer aromatik bileşiklerle karşılaştırıldığında nispeten düşüktür. C6H6’nın erime noktası, alternatif çift bağlara sahip düzlemsel bir karbon atomu halkasından oluşan moleküler yapısından kaynaklanmaktadır. Halkadaki elektronların dizilişi C6H6’ya karakteristik stabilitesini verir ve onu birçok kimyasal reaksiyona karşı dirençli kılar. C6H6’nın düşük erime noktası, bileşiğin daha ileri işlemler için eritilmesinin gerekli olduğu uygulamalarda onu faydalı kılar.
Benzen yoğunluğu g/ml
Benzenin yoğunluğu oda sıcaklığında (25°C veya 77°F) 0,879 g/mL’dir. Benzen yoğunluğu, bileşiğin birim hacmi başına kütlenin bir ölçüsüdür. Benzenin düşük yoğunluğu, bileşiklerin yoğunluklarına göre ayrılması gibi düşük yoğunluklu bir çözücünün gerekli olduğu uygulamalarda onu faydalı kılar.
Benzenin moleküler ağırlığı
Benzenin moleküler ağırlığı 78,11 g/mol’dür. Benzenin moleküler ağırlığı, kendisini oluşturan atomların atom ağırlıklarının toplamıdır. Benzenin moleküler ağırlığı, reaksiyonların stokiyometrisinin belirlenmesinde ve çözeltilerdeki benzen konsantrasyonunun belirlenmesinde önemlidir.
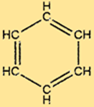
benzenin yapısı
C6H6, her biri diğer iki karbon atomuna ve bir hidrojen atomuna bağlı altıgen bir karbon atomu halkasından oluşan benzersiz bir yapıya sahiptir. Halkadaki alternatif çift bağlar C6H6’ya karakteristik stabilitesini verir ve onu birçok kimyasal reaksiyona karşı dirençli hale getirir. C6H6’nın yapısı aynı zamanda onu birçok önemli bileşiğin üretimi için yararlı bir hammadde haline getirir.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 0,879 gr/ml |
| Renk | Renksiz |
| Koku | Yumuşak |
| Molar kütle | 78,11 g/mol |
| Yoğunluk | 0,879 gr/ml |
| Füzyon noktası | 5,5°C (41,9°F) |
| Kaynama noktası | 80,1°C (176,2°F) |
| Flaş noktası | -11°C (12,2°F) |
| sudaki çözünürlük | 1,79 g/L |
| çözünürlük | Suda çözünmez, organik çözücülerde çözünür |
| Buhar basıncı | 20°C’de 12,1 kPa |
| Buhar yoğunluğu | 2,8 (hava=1) |
| pKa | 43.2 |
| pH | Doğal |
Benzen Güvenliği ve Tehlikeleri
C6H6, insan sağlığı ve çevre için önemli riskler oluşturan, son derece yanıcı ve toksik bir bileşiktir. Bilinen bir kanserojendir ve insanlarda lösemi, aplastik anemi ve diğer kan bozukluklarına neden olabilir. C6H6’ya maruz kalma, soluma, cilt teması veya yutma yoluyla meydana gelebilir ve sağlık üzerinde akut ve kronik etkilere neden olabilir. C6H6’nın yeterli havalandırma, koruyucu kıyafet ve solunum koruması dahil uygun güvenlik önlemleriyle kullanılması önemlidir. C6H6 ayrıca çevre kirliliğini ve halk sağlığı risklerini en aza indirmek için yerel düzenlemelere uygun olarak saklanmalı ve imha edilmelidir.
| Tehlike sembolleri | Kafatası ve Kemiklerin, Alev |
| Güvenlik Açıklaması | Son derece yanıcı, Toksik, Kanserojen, Yutulması halinde zararlı, Tahriş edici |
| BİR tanımlayıcılar | UN 1114 (Benzen), UN 1992 (Yanıcı, zehirli sıvılar) |
| HS kodu | 2902.20.00 |
| Tehlike sınıfı | 3 (Yanıcı sıvılar), 6.1 (Zehirli maddeler), 8 (Aşındırıcı maddeler) |
| Paketleme grubu | II (Benzen), III (Yanıcı, zehirli sıvılar) |
| Toksisite | Akut toksisite: Çok toksik (LD50: ağız yoluyla 2,5 g/kg, soluma yoluyla 0,44 mg/L), Kronik toksisite: Kanserojen, Mutajen, Üreme sistemi toksisitesi |
Benzen sentez yöntemleri
Plastik, kauçuk ve ilaç üretiminde kullanılan önemli bir endüstriyel kimyasal olan benzenin sentezlenmesi için çeşitli yöntemler vardır.
Yaygın bir yöntem, benzen de dahil olmak üzere aromatik hidrokarbonların bir karışımını üretmek için naftanın platin veya renyum gibi bir katalizör varlığında yüksek sıcaklıklara ısıtılmasını içeren petrol naftasının katalitik olarak yeniden düzenlenmesidir.
Başka bir yöntem, metil grubunu çıkarmak ve benzen oluşturmak için tolüenin krom oksit veya molibden oksit gibi bir katalizör varlığında hidrojen ile reaksiyona sokulmasını içeren toluen hidrodealkilasyonudur.
Kömür veya petrol gibi hidrokarbonların oksijen yokluğunda yüksek sıcaklıklarda pirolizi benzeni sentezler. Bu işlem benzen dahil aromatik hidrokarbonların bir karışımının oluşmasıyla sonuçlanır.
Benzen sentezlemenin diğer yöntemleri arasında asetilenin bakır gibi bir katalizör varlığında kendisiyle reaksiyona girerek benzen oluşturması ve fenolün formaldehit ile sülfürik asit gibi bir asit katalizörü varlığında reaksiyona girmesi yer alır. benzen oluşturur. benzen üretir.
Bu yöntemlerin her birinin maliyet, etkinlik ve çevresel etki gibi faktörlere bağlı olarak kendi avantaj ve dezavantajları vardır. Benzen sentezi yönteminin seçimi, özel uygulama ve üretim süreci gereksinimlerine bağlı olacaktır.
benzenin kullanımları
Benzen, çeşitli endüstrilerde geniş bir uygulama alanına sahip, çok yönlü ve önemli bir endüstriyel kimyasaldır. Benzenin ana kullanımlarından bazıları şunlardır:
- Plastik üretimi: Polistiren, poliüretan ve naylon dahil olmak üzere çeşitli plastik türlerinin üretiminde kullanılır.
- Kauçuk Üretimi: Sentetik kauçuk üreticileri bunu üretimlerinde kullanırlar. Üreticiler daha sonra bu sentetik kauçuğu lastikler, borular, kayışlar ve diğer kauçuk ürünleri oluşturmak için kullanırlar.
- Farmasötik üretim: Antibiyotikler, antihistaminikler ve analjezikler dahil olmak üzere çeşitli farmasötik ürünlerin üretiminde hammadde olarak kullanılır.
- Çözücü: Katı yağlar, sıvı yağlar, reçineler ve mumlar dahil olmak üzere çok çeşitli organik bileşikler için çözücü olarak kullanılır.
- Yakıt: Benzinli motorların performansını artıran yüksek oktanlı yakıt katkısı olarak kullanılır.
- Yağ Ekstraksiyonu: Bitkisel yağlar ve uçucu yağlar gibi yağların bitkilerden ekstraksiyonunda kullanılır.
- Yapıştırıcılar: Kauçuk çimento ve kontakt çimento gibi yapıştırıcıların üretiminde kullanılır.
- Boyalar: Tekstil endüstrisinde kullanılan sentetik boyalar da dahil olmak üzere çeşitli boya türlerinin üretiminde kullanılır.
Sorular:
S: Benzen polar mıdır?
C: Hayır, benzen polar olmayan bir moleküldür çünkü simetrik bir yapıya sahiptir ve bireysel bağların polariteleri birbirini götürür.
S: Benzen ne için kullanılır?
C: Benzen, plastik, kauçuk, farmasötik ürünler, solventler, yakıt katkı maddeleri, yapıştırıcılar ve boyalar dahil olmak üzere çeşitli malzemelerin üretiminde kullanılır.
Soru: Hangi bileşik suda çözündüğünde elektriği iletir? CH4, CuSO4, C6H6 veya C6H12O6?
C: CuSO4 suda çözündüğünde elektriği iletir çünkü iyonlara ayrışır ve elektrik akımının akmasını sağlar.
S: C6H6 polar mı yoksa polar değil mi?
C: Benzen olarak da bilinen C6H6, simetrik bir yapıya sahip olduğundan ve bireysel bağların polariteleri birbirini götürdüğünden polar olmayan bir moleküldür.
S: C6H6 suda çözünür mü?
C: Hayır, C6H6 suda çözünmez çünkü polar olmayan bir moleküldür ve su gibi polar çözücülerle iyi etkileşime girmez.
