Kalsiyum klorür, CaCl2 formülüne sahip, yüksek oranda çözünür inorganik bir bileşiktir. Yaygın olarak buz çözücü madde, kurutucu olarak ve kalsiyum tuzları ve kimyasalların üretiminde kullanılır.
| IUPAC Adı | Kalsiyum klorür |
| Moleküler formül | CaCl2 |
| CAS numarası | 10043-52-4 |
| Eş anlamlı | Kalsiyum diklorür, kalsiyum (II) klorür |
| E509, dekapaj tuzu, Dowflake, Peladow, TETRA | |
| InChI | InChI=1S/Ca.2ClH/h;2*1H/q+2;;/p-2 |
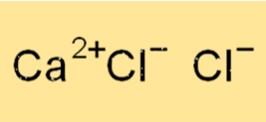
Kalsiyum Klorür Formülü
Kalsiyum klorürün kimyasal formülü CaCl2’dir. Bu, her bir kalsiyum klorür biriminin bir kalsiyum iyonu (Ca2+) ve iki klorür iyonundan (Cl-) oluştuğu anlamına gelir. Kalsiyum klorür iyonik bir bileşiktir, yani pozitif yüklü kalsiyum iyonu ile negatif yüklü klorür iyonları arasındaki elektrostatik çekimle bir arada tutulur.
Kalsiyum klorürün molar kütlesi
Kalsiyum klorürün molar kütlesi 110,98 g/mol’dür; bu, bir Ca atomu ve iki Cl atomunun atomik kütlelerinin toplamına karşılık gelir. Suda yüksek oranda çözünen inorganik bir bileşiktir. su ve yaygın olarak kurutma maddesi, kurutucu ve buz çözücü madde olarak kullanılır. Kalsiyum klorür ayrıca kalsiyum tuzları ve diğer kimyasalların üretiminde de kullanılır.
CaCl2’nin kaynama noktası
CaCl2’nin kaynama noktası 1935°C’dir ve bu, inorganik bir bileşik için çok yüksektir. Bunun nedeni Ca+2 ve Cl- iyonları arasındaki güçlü iyonik bağların kırılmasıdır. Bu bağların kırılması çok fazla enerji gerektirir. CaCl2 higroskopik bir bileşiktir, yani havadaki nemi emer ve yüksek konsantrasyonlu bir çözelti oluşturmak üzere suda çözünebilir.
CaCl2’nin erime noktası
CaCl2’nin erime noktası 772°C’dir. Kristal bir yapıya sahiptir ve genellikle susuz formda bulunur, yani su molekülü içermez. CaCl2 ısıtıldığında kalsiyum oksit ve hidrojen klorür gazına ayrışır.
CaCl2 yoğunluğu g/ml
CaCl2’nin yoğunluğu çözeltinin konsantrasyonuna bağlıdır. 1 M’lik bir CaCl2 çözeltisinin yoğunluğu yaklaşık 1,4 g/mL iken 3 M’lik bir çözeltinin yoğunluğu yaklaşık 1,6 g/mL’dir. Katı CaCl2’nin yoğunluğu 2,15 g/cm³’tür.
CaCl2’nin moleküler ağırlığı
CaCl2’nin moleküler ağırlığı 110,98 g/mol’dür. Bir Ca atomu ve iki Cl atomundan oluşan inorganik bir bileşiktir. CaCl2, oda sıcaklığında beyaz kristalli bir katıdır ve suda oldukça çözünür.
CaCl2’nin Yapısı
CaCl2, kalsiyum katyonu (Ca2+) ile klorür anyonu (Cl-) arasındaki iyonik bağlarla bir arada tutulan kristal kafes yapısına sahiptir. Her bir Ca+2 iyonu altı Cl- iyonu ile ve her bir klorür iyonu altı kalsiyum iyonu ile çevrelenmiştir. CaCl2’nin kristal yapısı kübiktir ve her birim hücre bir kalsiyum iyonu ve iki klorür iyonu içerir.
| Dış görünüş | Beyaz katı |
| Spesifik yer çekimi | 2,15 (katı), 1,4-1,6 (çözelti) |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 110,98 gr/mol |
| Yoğunluk | 2,15 g/cm³ (katı), 1,4-1,6 g/cm³ (çözelti) |
| Füzyon noktası | 772°C |
| Kaynama noktası | 1935°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suda çok çözünür |
| çözünürlük | Etanol ve asetonda çözünür |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | – |
| pH | 4,5-11,0 (%10’luk çözüm) |
Kalsiyum klorürün güvenliği ve tehlikeleri
CaCl2 cilt ve göz tahrişine neden olabilir ve tozunun veya buharının solunması solunum yolu tahrişine neden olabilir. Ayrıca cilt veya gözlerle teması halinde yanıklara neden olabilir. CaCl2 higroskopiktir, yani nemi emebilir ve ısıyı serbest bırakabilir, bu da kapların kırılmasına veya patlamasına neden olabilir. Aynı zamanda bazı metalleri aşındırır ve bazı organik maddelerle reaksiyona girebilir. CaCl2 ile çalışırken eldiven ve gözlük gibi uygun koruyucu ekipmanlar kullanılmalıdır. Dökülenler derhal temizlenmeli ve kaplar serin, kuru ve iyi havalandırılmış bir alanda saklanmalıdır.
| Tehlike sembolleri | Aşındırıcı, Tahriş Edici |
| Güvenlik Açıklaması | Koruyucu eldiven ve göz/yüz koruması kullanın. Tozunu/dumanını/gazını/sisini/buharını solumayın. |
| BM kimlik numaraları | UN 3077, UN 1786 (ons hidratlı) |
| HS kodu | 2827.39.90 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | III |
| Toksisite | Çoğu uygulamada toksisite düşüktür ancak büyük miktarlarda tehlikeli olabilir |
Kalsiyum klorür sentezi için yöntemler
CaCl2’yi sentezlemek için çeşitli yöntemler mevcuttur.
Bir yöntem, kalsiyum karbonatın veya kalsiyum hidroksitin hidroklorik asitle reaksiyona sokulmasını içerir. Bir yöntem, hidroklorik asite kalsiyum karbonat veya kalsiyum hidroksit eklemektir. Çözelti buharlaşarak CaCl2 verir.
Diğer bir yöntem ise kalsiyum oksidin hidroklorik asitle reaksiyona sokulmasıdır. Bu yöntem, hidroklorik asite kalsiyum oksit eklenmesini ve daha sonra CaCl2 elde etmek için çözeltinin buharlaştırılmasını içerir.
Üçüncü bir yöntem, metalik kalsiyumun klor gazı ile reaksiyona sokulmasını içerir. Daha az yaygın olan bir yöntem, kalsiyum metalinin klor gazı varlığında ısıtılmasıdır. Reaksiyon CaCl2 üretir, ancak kalsiyum metalinin yüksek reaktivitesi ve özel işlem ihtiyacı nedeniyle uzmanlar bu yaklaşımı sıklıkla kullanmazlar.
Farklı bir yöntem kullanarak CaCl2 üretmek için Solvay işleminin sodyum klorür ve CaCl2 üreten yan ürünü kullanılabilir. İşlem, filtreleme, buharlaştırma ve saflaştırma teknikleri yoluyla yan üründen CaCl2’nin çıkarılmasını içerir. Bu adımlar tüm safsızlıkların giderilmesine ve yüksek saflıkta CaCl2 üretilmesine yardımcı olur.
Kalsiyum Klorürün Kullanım Alanları
CaCl2’nin birçok endüstriyel uygulaması vardır:
- Nemi emmek için kurutucu, yollar ve kaldırımlar için buz çözücü ve tofu ve diğer gıdaların üretiminde pıhtılaştırıcı olarak kullanılır.
- Petrol ve gaz endüstrisinde sondaj sıvılarının yoğunluğunu arttırmak ve boru hatlarındaki suyun donma noktasını azaltmak için kullanılır.
- Kürleme sürecini hızlandırmak ve bitmiş ürünün mukavemetini ve dayanıklılığını arttırmak için beton karışımlarında kullanılır.
- Kağıt üretiminde kağıt liflerinin mukavemetini ve stabilitesini arttırmak için kullanılır.
- Su arıtımında yabancı maddeleri uzaklaştırmak ve suyu yumuşatmak için kullanılır.
- İntravenöz sıvılar gibi tıbbi uygulamalarda ve hipokalsemiyi tedavi etmek için kalsiyum iyonu kaynağı olarak kullanılır.
- Plastik ve kauçuk üretiminde nihai ürünün sertliğini ve dayanıklılığını arttırmak için kullanılır.
- Meyve ve sebzelerin muhafazasında bozulmayı önlemek, ürünün dokusunu ve lezzetini korumak amacıyla kullanılır.
- Tekstil üretiminde boya emilimini arttırmak ve elyaf mukavemetini ve esnekliğini arttırmak için kullanılır.
- Ayrıca yangın söndürücülerin üretiminde ve alevlerin yayılmasını önlemek için alev geciktirici malzemelerin bir bileşeni olarak kullanılır.
Sorular:
S: Kalsiyum klorür nedir?
A: Kalsiyum klorür, CaCl2 kimyasal formülüne sahip, Ca2+ ve Cl- iyonlarından oluşan kimyasal bir bileşiktir.
S: Kalsiyum klorür iyonik mi yoksa kovalent mi?
C: CaCl2 iyonik bir bileşiktir çünkü iyonik bağlarla bir arada tutulan pozitif yüklü Ca2+ iyonlarından ve negatif yüklü Cl- iyonlarından oluşur.
S: Kalsiyum klorür ne için kullanılır?
C: CaCl2’nin, kurutucu, buz çözücü madde, gıda üretiminde pıhtılaştırıcı, betonda hızlandırıcı, su yumuşatıcı ve tıbbi tedavilerde kalsiyum iyonu kaynağı dahil olmak üzere birçok endüstriyel, ticari ve tıbbi kullanımı vardır.
Soru: Kalsiyum klorürün formülü nedir?
C: Kalsiyum klorürün formülü CaCl2’dir; bu, her molekülün bir kalsiyum iyonu ve iki klorür iyonu içerdiğini gösterir.
S: CaCl2 iyonik mi yoksa kovalent mi?
C: CaCl2 iyonik bir bileşiktir çünkü iyonik bağlarla bir arada tutulan pozitif yüklü kalsiyum iyonları ve negatif yüklü klorür iyonlarından oluşur.
S: CaCl2 suda çözünür mü?
C: Evet, CaCl2 suda oldukça çözünür, yani suda kolayca çözünerek berrak bir çözelti oluşturabilir.
Soru: Eğer CaCl2 suda çözülürse Ca2+ iyonunun konsantrasyonu hakkında ne söyleyebiliriz?
C: CaCl2 suda çözündüğünde kendisini oluşturan Ca2+ ve 2Cl- iyonlarına ayrışır. CaCl2 suda tamamen ayrıştığı için çözeltideki Ca2+ iyonlarının konsantrasyonu CaCl2 konsantrasyonunun iki katıdır.
