Kalsiyum nitrat, Ca(NO3)2 formülüne sahip kimyasal bir bileşiktir. Suda çok çözünür, renksiz ve kokusuz bir katıdır. Kalsiyum nitrat yaygın olarak gübre olarak ve atık su arıtımında kullanılır. Ayrıca beton üretiminde, patlayıcıların bir bileşeni olarak ve diğer çeşitli kimyasalların imalatında da kullanılır.
| IUPAC Adı | Kalsiyum dinitrat |
| Moleküler formül | Ca(NO3)2 |
| CAS numarası | 10124-37-5 |
| Eş anlamlı | Kalsiyum nitrat tetrahidrat, nitrik asidin kalsiyum tuzu, nitrokalsit, Norveç güherçilesi, kireç güherçilesi, Norgessalpeter |
| InChI | InChI=1S/Ca.2NO3/c;22-1(3)4/q+2;2-1 |
Kalsiyum nitrat formülü
Kalsiyum nitratın formülü Ca(NO3)2’dir. Bu, her bir kalsiyum nitrat biriminin bir kalsiyum iyonu (Ca²⁺) ve iki nitrat iyonu (NO3⁻) içerdiği anlamına gelir. Kalsiyum nitrat formülü genellikle bileşiğin molar kütlesini ve diğer özelliklerini belirlemek için kullanılır.
Kalsiyum Nitrat Molar Kütlesi
Kalsiyum nitratın molar kütlesi 164.088 g/mol’dür. Ca(NO3)2 formülüne sahip, Ca+2 ve NO3- iyonlarından oluşan bir tuzdur. Bir bileşiğin molar kütlesi, o formül bileşiğinin bir molünün ağırlığına eşit olan gram cinsinden kütlesidir. Ca(NO3)2 durumunda formül ağırlığı, bileşikteki tüm atomların atom ağırlıklarının toplamıdır.
Kalsiyum nitratın kaynama noktası
Ca(NO3)2, 132 santigrat derece gibi nispeten yüksek bir kaynama noktasına sahiptir. Bu, katı bileşiği gaza dönüştürmek için önemli miktarda enerji gerektiği anlamına gelir. Ca(NO3)2’nin yüksek kaynama noktası, Ca+2 ve NO3- iyonları arasında güçlü elektrostatik etkileşimlere yol açan iyonik yapısından kaynaklanmaktadır.
Kalsiyum Nitrat Erime Noktası
Ca(NO3)2’nin erime noktası 561 santigrat derecedir. Bu, bir tuz için nispeten yüksektir ve bir kez daha Ca+2 ve NO3- iyonları arasındaki güçlü iyonik etkileşimleri yansıtır. Ca(NO3)2’nin erime noktası, onu gübre veya patlayıcı üretimi gibi yüksek sıcaklık uygulamaları için yararlı bir bileşik haline getirir.
Kalsiyum nitratın yoğunluğu g/ml
Ca(NO3)2’nin yoğunluğu şekline bağlı olarak değişir. Örneğin susuz Ca(NO3)2’nin yoğunluğu yaklaşık 2,5 g/cm³ iken tetrahidratın (Ca(NO3)2,4H2O) yoğunluğu yaklaşık 1,82 g/cm³’tür. Bu değerler Ca(NO3)2’yi diğer birçok tuza kıyasla nispeten yoğun bir bileşik haline getirir.
Kalsiyum Nitrat Molekül Ağırlığı
Ca(NO3)2’nin molekül ağırlığı 164.088 g/mol’dür. Bu değer, iki nitrojen atomu, altı oksijen atomu ve bir kalsiyum atomu içeren bileşikteki tüm atomların atom ağırlıklarının toplamıdır.
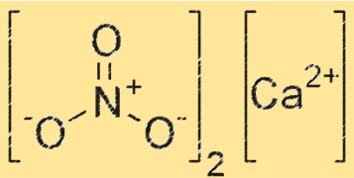
Kalsiyum nitratın yapısı
Ca(NO3)2, kalsiyum iyonunun (Ca²⁺) oktahedral bir düzende altı oksijen atomu ile çevrelendiği iyonik bir yapıya sahiptir. NO3- iyonu da kristal kafeste mevcuttur; NO3- iyonunun her bir oksijen atomu, Ca+2 iyonu ile bir koordinasyon bağı oluşturur. Ca(NO3)2’nin yapısı sodyum klorür gibi diğer iyonik bileşiklerinkine benzer.
| Dış görünüş | Beyaz kristaller veya toz |
| Spesifik yer çekimi | 2,5 (susuz); 1.82 (tetrahidrat) |
| Renk | Renksiz (susuz); Beyaz (tetrahidrat) |
| Koku | Kokusuz |
| Molar kütle | 164.088 gr/mol |
| Yoğunluk | 2,5 g/cm³ (susuz); 1,82 g/cm³ (tetrahidrat) |
| Füzyon noktası | 561°C (susuz); 45°C (tetrahidrat) |
| Kaynama noktası | 132°C (ayrışır) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 121,2g/100ml (0°C); 126,7g/100ml (20°C); 179,6g/100ml (100°C) |
| çözünürlük | Suda, etanolde, metanolde çözünür |
| Buhar basıncı | İhmal edilebilir (susuz) |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | 4,5-7,5 (%10’luk çözüm) |
Kalsiyum nitratın güvenliği ve tehlikeleri
Kalsiyum nitrat (Ca(NO3)2), uygun şekilde kullanılmazsa çeşitli tehlikelere yol açabilir. Yanıcı maddelerle teması halinde yangına veya patlamaya neden olabilecek güçlü bir oksitleyici maddedir. Bileşik ayrıca temas halinde ciltte ve gözde tahrişe neden olabilir ve tozun solunması solunum yolu tahrişine neden olabilir. Ca(NO3)2 serin, kuru, ısı kaynaklarından uzak bir yerde saklanmalı ve uygun önlemler alınmadan diğer kimyasallarla karıştırılmamalıdır. Ca(NO3)2 ile çalışırken cilt veya gözlerle teması önlemek için eldiven ve göz koruması gibi kişisel koruyucu ekipmanlar giyilmelidir. Yanlışlıkla yutulması durumunda derhal tıbbi yardıma başvurulmalıdır.
| Tehlike sembolleri | Oksitleyici madde (GHS05), Tahriş edici (GHS07) |
| Güvenlik Açıklaması | S22: Tozunu/dumanını/gazını/sisini/buharını/aerosollerini solumayın. S26: Göz ile teması halinde derhal bol su ile yıkayın ve doktora başvurun. S36/37/39: Uygun koruyucu kıyafet, eldiven ve göz/yüz koruması kullanın. |
| BİR tanımlayıcılar | UN1454 (Kalsiyum nitrat susuz), UN1455 (Kalsiyum nitrat tetrahidrat) |
| HS kodu | 283429 |
| Tehlike sınıfı | 5.1 (Oksitleyici maddeler) |
| Paketleme grubu | III |
| Toksisite | Ağızdan (LD50): 3.420 mg/kg (sıçan); Dermal (LD50): > 5.000 mg/kg (tavşan); Soluma (LC50): >4,8 mg/l/4 sa (sıçan) |
Kalsiyum nitrat sentez yöntemleri
Spesifik uygulamaya ve istenen saflığa bağlı olarak Ca(NO3)2’yi sentezlemek için çeşitli yöntemler vardır.
Yaygın bir yöntem, Ca(NO3)2 ve karbon dioksit üretmek için kalsiyum karbonatın nitrik asitle reaksiyona sokulmasıdır:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Diğer bir yöntem ise kalsiyum hidroksitin nitrik asitle reaksiyona sokulmasıdır:
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
Nitrik asit ile kalsiyum oksit arasındaki reaksiyon Ca(NO3)2 verir:
CaO + 2HNO3 → Ca(NO3)2 + H2O
Ortaya çıkan Ca(NO3)2, yeniden kristalleştirme yoluyla veya demir ve alüminyum gibi yabancı maddeleri çıkarmak için az miktarda sülfürik asit eklenerek daha da saflaştırılabilir.
Üreticiler, kalsiyum metalini nitrik asitle reaksiyona sokarak veya kalsiyum hidroksiti amonyum nitratla reaksiyona sokarak Ca(NO3)2 üretebilirler. Ancak reaktif metaller veya amonyum nitratla ilgili yüksek maliyet veya güvenlik endişeleri nedeniyle bu yöntemleri daha az kullanıyorlar.
Kalsiyum Nitratın Kullanım Alanları
- Bitkilere büyüme için kalsiyum ve azot besinleri sağlamak amacıyla tarımda gübre olarak kullanılır.
- Çeşitli beton ve çimento türlerinde mukavemet ve dayanıklılıklarını arttırmak için bileşen olarak kullanılır.
- Fosfor ve nitrojen bileşiklerinin sudan uzaklaştırılmasına yardımcı olmak için atık su arıtma kimyasallarının üretiminde katkı maddesi olarak kullanılır.
- Oksitleyici özelliğinden dolayı çeşitli patlayıcı ve havai fişek türlerinin üretiminde kullanılır.
- Naylon ve diğer sentetik elyaflar gibi çeşitli kimyasalların üretiminde kalsiyum ve nitrojen kaynağı olarak kullanılır.
- Endüstriyel uygulamalarda alüminyum ve çelik gibi metaller için korozyon önleyici olarak kullanılır.
- Et muhafazasında ve bazı gıda ürünlerinin kalitesini artırmak için gıda katkı maddesi olarak kullanılır.
- Askeri ve sivil uygulamalara yönelik sis bombası ve işaret fişeği üretiminde kullanılır.
- Bazı gübrelerin üretiminde kullanılır. Ayrıca mahsullere dengeli bir besin kaynağı sağlamak için diğer bileşiklerle kombinasyon halinde kullanılır.
- Su bitkilerine gerekli besinleri sağlamak için bazı özel akvaryum gübrelerinde bir bileşen olarak kullanılır.
Sorular:
Soru: Ca(NO3)2’nin adı nedir?
C: Ca(NO3)2’nin adı kalsiyum nitrattır.
S: Ca(NO3)2 suda çözünür mü?
C: Evet, Ca(NO3)2 suda oldukça çözünür. Oda sıcaklığında 100 gram su, 121 grama kadar kalsiyum nitratı çözebilir.
S: Kalsiyum nitrat nereden alınır?
C: Ca(NO3)2 çeşitli kimyasal tedarikçilerinden, internet üzerinden ve mağazalardan satın alınabilir. Ca(NO3)2’nin satın alınabileceği bazı yaygın yerler arasında bilimsel tedarik şirketleri, çiftlik malzemesi mağazaları ve ev ve bahçe merkezleri bulunmaktadır. Tedarikçinin saygın olmasını, ürünün yüksek kalitede ve amaçlanan uygulamaya uygun olmasını sağlamak önemlidir.
