Potasyum klorür (KCl), potasyum ve klor içeren bir bileşiktir. Düşük potasyum seviyeleri için gübre, gıda katkı maddesi ve tıbbi tedavi olarak kullanılır. Ölümcül enjeksiyonlarda da kullanılabilir.
| IUPAC Adı | Potasyum klorür |
| Moleküler formül | KCI |
| CAS numarası | 7447-40-7 |
| Eş anlamlı | KCl, Kalium Chloratum, Potash Muriate, Sylvite, Kloropotassuril, Kalitabs, Klotrix, Klor-Con, K-Dur |
| InChI | InChI=1S/ClH.K/h1H;/q;+1/p-1 |
Potasyum Klorür Formülü
Potasyum klorürün kimyasal formülü KCl’dir. Bir potasyum atomu ve bir klor atomundan oluşan ikili bir bileşiktir. Potasyum klorürün formülü, kimyasal özelliklerinin anlaşılması ve çeşitli uygulamalardaki kullanımına ilişkin hesaplamaların yapılması açısından önemlidir.
Potasyum klorürün molar kütlesi
KCl’nin molar kütlesi 74,55 g/mol’dür. Tuzlu bir tada sahip ve suda oldukça çözünür olan beyaz kristal bir katıdır. KCl, bir potasyum atomu ve bir klor atomundan oluşan bir bileşiktir.
Potasyum klorürün kaynama noktası
KCl’nin kaynama noktası 1.420 °C’dir (2.588 °F). Kaynama noktasına ulaşmak için önemli miktarda enerji gerektiren yüksek erime noktalı bir bileşiktir. KCl’nin yüksek kaynama noktası, onu seramik ve cam üretimi gibi yüksek sıcaklık uygulamalarında faydalı kılar.
KCl’nin erime noktası
KCl’nin erime noktası 770°C’dir (1,418°F). Erimek için önemli miktarda ısı gerektiren nispeten yüksek erime noktalı bir bileşiktir. KCl gübre üretiminde kullanılır ve yüksek erime noktası, yüksek sıcaklıklarda stabilitesinin sağlanmasına yardımcı olur.
KCl yoğunluğu g/ml
KCl’nin yoğunluğu 1,98 g/cm³’tür. Nispeten yoğun bir bileşiktir, yani küçük bir miktar çok sayıda parçacık içerir. KCl’nin yüksek yoğunluğu, sondaj sıvılarının üretimi gibi bazı endüstriyel uygulamalarda onu faydalı kılar.
KCl’nin moleküler ağırlığı
KCl’nin moleküler ağırlığı 74,55 g/mol’dür. Nispeten hafif bir bileşiktir, yani az sayıda parçacık içerir. KCl’nin düşük moleküler ağırlığı, endüstriyel ortamlarda taşınmasını ve kullanılmasını kolaylaştırır.
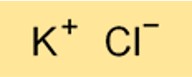
KCl yapısı
KCl’nin yapısı iyonik bir kristal kafestir. Tekrarlanan bir düzende düzenlenmiş alternatif potasyum ve klor iyonlarından oluşur. Yapının iyonik doğası, KCl’nin suda çözündüğünde iyi bir elektrik iletkeni olduğu anlamına gelir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 1,98 g/cm³ |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 74,55 gr/mol |
| Yoğunluk | 1,98 g/cm³ |
| Füzyon noktası | 770°C (1,418°F) |
| Kaynama noktası | 1420°C (2588°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 34,7g/100ml (0°C) |
| çözünürlük | Suda, gliserolde ve formamidde çözünür; etanolde az çözünür |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | -1.8 (konjuge asit) |
| pH | 7 (%10’luk çözüm) |
Potasyum Klorür Güvenliği ve Tehlikeleri
Potasyum klorür (KCl), taşınırken veya kullanılırken dikkate alınması gereken potansiyel tehlikelere ve güvenlik sorunlarına sahiptir. Bu ciltte ve gözde tahrişe neden olabilir ve uzun süreli maruz kalma kimyasal yanıklara neden olabilir. KCl tozunun solunması solunum yolu tahrişine ve öksürüğe neden olabilir. Ek olarak, büyük miktarlarda KCl’nin yutulması elektrolit dengesizliklerine ve kardiyak aritmilere yol açabilir. Eldiven ve göz koruması gibi uygun kişisel koruyucu ekipmanların kullanılması ve KCl’nin iyi havalandırılmış bir alanda işlenmesi önemlidir. Cilt veya göz ile teması halinde etkilenen bölgenin iyice yıkanması ve gerekiyorsa doktora başvurulması önemlidir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Cilt ve göz tahrişine neden olur. Yutulduğunda zararlı. |
| BİR KİMLİK | UN1480 |
| HS kodu | 310420 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | LD50 (sıçan, ağızdan): 2.500 mg/kg |
Potasyum klorür sentez yöntemleri
Aşağıdakiler de dahil olmak üzere çeşitli yöntemler potasyum klorürü (KCl) sentezleyebilir:
- Çözünme ve kristalleştirme: Bu yöntem, KCl’nin suda çözülmesini ve ardından çözeltinin buharlaşmasına izin vererek geride katı KCl kristallerini bırakmayı içerir.
- İyon değişimi: KCl üretmek için, sodyum klorür gibi başka bir tuzun çözeltisindeki iyonlar, potasyum iyonlarıyla değiştirilebilir. Endüstriler bu yöntemi KCl gübrelerinin üretiminde yaygın olarak kullanır.
- Elektroliz: Bir KCl çözeltisinin elektrolizi, KCl’yi oluşturmak üzere birleşen elementel potasyum ve klor gazı üretir.
- Potasyum Hidroksitin Hidroklorik Asit ile Reaksiyonu: Potasyum hidroksit, KCl ve su üretmek için hidroklorik asit ile reaksiyona girebilir.
- Potasyum Karbonatın Hidroklorik Asit ile Reaksiyonu: Potasyum karbonat hidroklorik asit ile reaksiyona girerek KCl, karbondioksit ve su üretebilir.
Her yöntemin kendine göre avantajları ve dezavantajları vardır ve yöntemin seçimi, ürünün gerekli saflığı, üretim ölçeği, hammadde ve ekipmanın maliyeti gibi faktörlere bağlı olabilir.
Potasyum Klorürün Kullanım Alanları
Potasyum klorürün geniş bir kullanım alanı vardır:
- Gübre: Bitki büyümesi için gerekli besin maddelerini sağlamak amacıyla gübre olarak kullanılır.
- Gıda katkı maddesi: İşlenmiş gıdalarda sodyum alımını azaltmak için tuz yerine kullanılır.
- Su Arıtma: Su arıtma sistemlerine korozyon ve kireç oluşumunu önlemek amacıyla eklenir.
- Tıbbi Uygulamalar: Elektrolitleri değiştirmek ve hipokalemi gibi durumları tedavi etmek için intravenöz sıvılarda ve oral rehidrasyon solüsyonlarında kullanılır.
- Endüstriyel uygulamalar: Cam, seramik ve sabun üretiminde ve diğer kimyasalların üretiminde hammadde olarak kullanılır.
- Hayvan Yemi: Temel besin maddelerini sağlamak için hayvan yemine eklenir.
- Buz Çözücü Madde: Yollarda ve kaldırımlarda buz ve karı eritmek için buz çözücü madde olarak kullanılır.
- Petrol ve Gaz Sondajı: Petrol ve gaz sondaj operasyonlarında kil stabilizatörü olarak kullanılır.
- Laboratuvar Reaktifi: Laboratuvar deneylerinde ve analizlerinde reaktif olarak kullanılır.
Sorular:
S: Potasyum klorür nedir?
A: Potasyum klorür (KCl), potasyum ve klor iyonlarından oluşan beyaz kristalli bir tuzdur. Tarım, gıda, ilaç ve kimya imalatı gibi endüstrilerde birçok uygulaması vardır.
S: Potasyum klorür ne için kullanılır?
C: Potasyum klorür yaygın olarak gübre, gıda katkı maddesi olarak ve tıbbi uygulamalarda hipokalemi gibi durumların tedavisinde kullanılır. Ayrıca su arıtma, endüstriyel prosesler, hayvan besleme, buz çözme, petrol ve gaz sondajı ve laboratuvar deneylerinde de kullanılabilir.
S: Potasyum klorür güvenli midir?
C: Potasyum klorür büyük miktarlarda yutulursa veya gözlerle veya ciltle temas ederse zararlı olabilir. Potasyum klorürü kullanırken veya kullanırken uygun güvenlik yönergelerine ve düzenlemelerine uymak önemlidir.
S: KCl suda çözünür mü?
C: Evet, KCl suda oldukça çözünür. Oda sıcaklığında 1 gram KCl, 1,5 ml suda çözülebilir.
S: KCl iyonik mi yoksa kovalent mi?
C: KCl iyonik bir bileşiktir çünkü iyonik bağlarla bir arada tutulan pozitif yüklü potasyum iyonları ve negatif yüklü klorür iyonlarından oluşur.
Soru: KCl asit mi yoksa baz mı?
C: Potasyum klorür nötr bir bileşiktir ve ne asit ne de bazdır.
S: KCl güçlü bir elektrolit midir?
C: Evet, KCl güçlü bir elektrolittir çünkü suda çözündüğünde tamamen potasyum ve klorür iyonlarına ayrışır ve elektriksel iletkenliğe izin verir.
