Sodyum klorür (NaCl), sodyum ve klor iyonlarından oluşan bir bileşiktir. Yaygın olarak sofra tuzu olarak adlandırılır ve yiyecekleri baharatlamak ve gıda ürünlerini korumak için kullanılır.
| IUPAC Adı | Sodyum klorit |
| Moleküler formül | NaCl |
| CAS numarası | 7647-14-5 |
| Eş anlamlı | Halit, kaya tuzu, tuzlu su çözeltisi, deniz tuzu |
| InChI | InChI=1S/ClH.Na/h1H;/q;+1/p-1 |
Sodyum Klorür Formülü
Sodyum klorürün kimyasal formülü, bir sodyum iyonu (Na+) ve bir klorür iyonunun (Cl-) kombinasyonunu temsil eden NaCl’dir. Formül, bileşikteki göreceli atom veya iyon sayısını gösterir ve bileşiminin kolay tanımlanmasına ve temsil edilmesine olanak tanır.
NaCl’nin molar kütlesi
Sofra tuzu olarak da adlandırılan sodyum klorürün molar kütlesi 58,44 g/mol’dür. Bu, bir mol sodyum klorürün 58.44 gram bileşik içerdiği anlamına gelir. Molar kütle, bileşikteki sırasıyla 22,99 g/mol ve 35,45 g/mol olan sodyum (Na) ve klorin (Cl) atomik kütlelerinin eklenmesiyle hesaplanır.
Sodyum klorürün kaynama noktası
Sodyum klorür, iyonik bağı nedeniyle 1,413 °C (2,575 °F) gibi yüksek bir kaynama noktasına sahiptir. Isıtıldığında, enerji girişi sodyum ve klorür iyonları arasındaki iyonik bağları kırarak bileşiğin katı halden sıvı duruma geçmesine neden olur. İyonlar arasındaki güçlü elektrostatik çekim nedeniyle sodyum klorürün kaynama noktası diğer birçok bileşikten daha yüksektir.
Sodyum klorürün erime noktası
Sodyum klorürün erime noktası 801°C’dir (1474°F). Kaynama noktası gibi yüksek erime noktası da sodyum ve klorür iyonları arasındaki güçlü iyonik bağlardan kaynaklanmaktadır. Isıtıldığında enerji girişi, iyonları bir arada tutan elektrostatik kuvvetlerin üstesinden gelir ve bileşiğin katı halden sıvı duruma geçmesine neden olur.
Sodyum klorür yoğunluğu g/ml
Sodyum klorürün yoğunluğu oda sıcaklığında (25°C veya 77°F) 2,165 g/mL’dir. Yoğunluk, bir maddenin birim hacmi başına kütlenin bir ölçüsüdür. Sodyum klorürün yüksek yoğunluğu, atomlarının kompakt düzeninden ve sodyum ile klorür iyonları arasındaki güçlü iyonik bağdan kaynaklanmaktadır.
Sodyum klorürün moleküler ağırlığı
Sodyum klorürün moleküler ağırlığı daha önce de belirtildiği gibi 58,44 g/mol’dür. Molekül ağırlığı, bir moleküldeki tüm atomların atom ağırlıklarının toplanmasıyla hesaplanır. Sodyum klorür geleneksel anlamda bir molekül olarak mevcut olmasa da, molekül ağırlığı NaCl formül birimine göre hesaplanır.
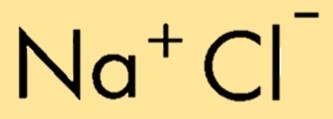
Sodyum klorürün yapısı
Sodyum klorür, sodyum ve klorür iyonlarının 1:1 oranında düzenli dizilişinden oluşan bir kristal yapıya sahiptir. Yapı, her bir sodyum iyonunun altı klorür iyonu ve her bir klorür iyonunun altı sodyum iyonu ile çevrelendiği, yüz merkezli bir kübik kafestir. Sodyum klorürdeki iyonik bağ, çok kararlı ve kırılması zor bir ağ yapısıyla sonuçlanır.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 2.165 |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 58,44 gr/mol |
| Yoğunluk | 2,165 gr/ml |
| Füzyon noktası | 801°C (1474°F) |
| Kaynama noktası | 1.413°C (2.575°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 20°C’de 359 g/L |
| çözünürlük | Suda ve gliserolde çözünür; etanol ve asetonda çözünmez |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 7 |
| pH | 7 (nötr) |
Sodyum klorürün güvenliği ve tehlikeleri
Sodyum klorür (NaCl) genellikle insan tüketimi ve kullanımı için güvenli kabul edilir. Ancak yüksek konsantrasyonda NaCl’ye maruz kalmak gözlerde, ciltte ve solunum yollarında tahrişe neden olabilir. Büyük miktarlarda NaCl’nin yutulması dehidrasyona, elektrolit dengesizliklerine ve hatta ölüme yol açabilir. Sodyum klorür yanıcı maddelerle temas ettiğinde yangın ve patlama tehlikesi de oluşturabilir. Kazaları önlemek için uygun taşıma ve depolama gereklidir. Hasar riskini en aza indirmek için NaCl’yi tutarken ve kullanırken uygun yönergelere ve güvenlik önlemlerine uymak önemlidir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Yutulması veya solunması halinde zararlıdır. Cilt ve göz tahrişine neden olur. |
| BM kimlik numaraları | BM 7646 |
| HS kodu | 2501.00.90 |
| Tehlike sınıfı | Toksik olmayan |
| Paketleme grubu | Uygulanamaz |
| Toksisite | LD50 (ağızdan, sıçan) – 3.000 mg/kg |
Sodyum klorür sentezi için yöntemler
Tuz madenleri ve deniz suyu da dahil olmak üzere çeşitli kaynaklar sodyum klorür sağlayabilir, ancak bunu laboratuvarda kimyasal reaksiyonlar yoluyla sentezlemek de mümkündür.
Sodyum klorürün sentezlenmesi için yaygın bir yöntem , hidroklorik asit (HCl) ve sodyum hidroksitin (NaOH) reaksiyona sokulmasını içerir. Bu reaksiyon, yan ürünler olarak sodyum klorür ve su üretir. Bu reaksiyonun denklemi şöyledir:
HCl + NaOH → NaCl + H2O
Başka bir yöntem, sodyum karbonatın (Na2CO3) hidroklorik asit (HCl) ile reaksiyona sokularak sodyum klorür, karbon dioksit ve su üretilmesini içerir. Bu reaksiyonun denklemi şöyledir:
2HCl + Na2CO3 → 2NaCl + CO2 + H2O
Sodyum ve klor gazı arasındaki reaksiyon, sodyum klorürün sentezlenmesine yönelik bu tür yöntemlerden biridir. Bu reaksiyon, istenmeyen yan ürünlerin oluşumunu önlemek için yüksek sıcaklıklar ve dikkatli kontrol gerektirir. Bu reaksiyonun denklemi şöyledir:
2Na + Cl2 → 2NaCl
Kimyacılar, maliyet, reaktiflerin mevcudiyeti ve nihai ürünün istenen saflığı ve verimi gibi faktörlere dayalı olarak sodyum klorür sentez yöntemlerini değiştirmeyi veya çeşitlendirmeyi seçebilirler. Bu yöntemler, doğal kaynaklar nadir olsa bile sodyum klorür üretimini sağlar.
Sodyum klorürün kullanım alanları
Sofra tuzu olarak da bilinen sodyum klorürün çeşitli endüstrilerde ve uygulamalarda birçok kullanımı vardır. Sodyum klorürün yaygın kullanımlarından bazıları şunlardır:
- Gıda Endüstrisi: Atıştırmalıklar, işlenmiş etler ve fırınlanmış ürünler de dahil olmak üzere çeşitli gıda ürünlerinde baharat ve lezzet arttırıcı olarak kullanılır.
- Medikal Endüstrisi: Vücudun sıvı ve elektrolitlerini yenilemek için intravenöz solüsyonlarda ve diğer tıbbi tedavilerde kullanılır.
- Kimya endüstrisi: Klor, sodyum hidroksit ve sodyum karbonat dahil olmak üzere çeşitli kimyasalların üretiminde kullanılır.
- Su Arıtma: Su arıtımında yabancı maddeleri uzaklaştırmak ve içmeye uygun hale getirmek için kullanılır.
- Tarım: Özellikle toprağın temel besin maddelerinden yoksun olduğu bölgelerde mahsuller için gübre olarak kullanılır.
- Buz çözücü: Kış aylarında yol ve kaldırımlarda kaygan yüzeylerden kaynaklanan kazaları önlemek amacıyla buz çözücü olarak kullanılır.
- Tekstil endüstrisi: Naylon ve polyester gibi sentetik elyafların üretiminde kullanılır.
- Petrol ve gaz endüstrisi: Petrol ve gaz sondajı ve çıkarılmasında kullanılır.
- Hayvancılık: Hayvancılıkta sağlıklı büyüme ve gelişmeyi teşvik etmek için besin takviyesi olarak kullanılır.
Bunlar sodyum klorürün birçok kullanımına ilişkin yalnızca birkaç örnektir. Çok yönlülüğü ve bulunabilirliği, onu geniş bir endüstri yelpazesindeki birçok ürün ve süreçte önemli bir bileşen haline getiriyor.
Sorular:
Soru: Sodyum klorür bir bileşik midir?
C: Evet, sodyum klorür bir bileşiktir.
S: Sodyum klorür iyonik mi yoksa kovalent mi?
Cevap: Sodyum klorür iyonik bir bileşiktir.
Soru: Sodyum klorür nedir?
A: Sodyum klorür, NaCl kimyasal formülüne sahip beyaz kristalli bir bileşiktir. Yaygın olarak sofra tuzu olarak adlandırılır ve insan ve hayvan beslenmesi için gereklidir.
S: Sodyum klorür ne için kullanılır?
C: Sodyum klorürün, gıdalarda baharat ve lezzet arttırıcı olarak, tıbbi tedavide, kimyasal üretimde, su arıtmada, buz çözücü madde olarak, tekstilde ve petrolde dahil olmak üzere çeşitli endüstrilerde ve uygulamalarda birçok kullanımı vardır. ve gaz ve hayvancılık için yem takviyesi olarak.
Soru: Sodyum klorür suda çözünür mü?
C: Evet, sodyum klorür suda oldukça çözünür.
