Klorik asit (HClO3), klor dioksitin suyla karıştırılmasıyla üretilebilen güçlü, kararsız bir asittir. Ağartma ve dezenfeksiyon maddelerinin yanı sıra patlayıcı üretiminde de kullanılır.
| IUPAC Adı | Klorik asit |
| Moleküler formül | HClO3 |
| CAS numarası | 7790-93-4 |
| Eş anlamlı | Perklorik asit, klorat; Klorik asit çözeltisi; Klorik asit (V); Hidrojen klorat; Hidrojen triklorat |
| InChI | InChI=1S/ClHO3/c2-1(3)4/h(H,2,3,4) |
Klorik asidin (HClO3) özellikleri, birçok endüstriyel uygulaması nedeniyle kimyagerlerin ve mühendislerin özellikle ilgisini çekmektedir.
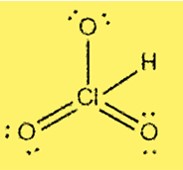
Lewis Yapısı HClO3
HClO3’ün Lewis yapısı, klorun üç oksijen atomuna ve bir hidrojen atomuna bağlı merkezi atom olduğunu gösterir. Klorun 7 değerlik elektronu vardır ve her oksijenin 6 değerlik elektronu vardır. Yapı, klor ve oksijen atomları arasında üç tekli bağ ve bir çift bağ içerir.
Klorik asit (HClO3) formülü
Klorik asitin (HClO3) kimyasal formülü HClO3’tür. Bir klor atomu, bir hidrojen atomu ve üç oksijen atomu içeren inorganik bir asittir. Klorik asit (HClO3) formülü, asit içeren çözeltilerin stokiyometrisini ve konsantrasyonunu hesaplamak için kullanılır.
Klorik asit (HClO3) molar kütlesi
Klorik asidin (HClO3) molar kütlesi 84,46 g/mol’dür. Molar kütlesi 98.08 g/mol olan sülfürik asit gibi diğer inorganik asitlerle karşılaştırıldığında nispeten hafif bir asittir. Klorik asidin molar kütlesi (HClO3), asit içeren çözeltilerin konsantrasyonunun ve stokiyometrisinin hesaplanmasında önemli bir parametredir.
Klorik asitin (HClO3) kaynama noktası
Klorik asitin (HClO3) kaynama noktası 40,5°C’dir. Yüksek sıcaklıklarda ayrışabilen, işlenmesini ve saklanmasını zorlaştıran çok uçucu bir asittir. Klorik asidin (HClO3) düşük kaynama noktası, asit kullanımını içeren ekipman ve proseslerin tasarımında önemli bir husustur.
Klorik asidin erime noktası (HClO3)
Klorik asitin (HClO3) iyi tanımlanmış bir erime noktası yoktur. Erime noktasına ulaşmadan ayrışabilir, oksijen gazı açığa çıkarabilir ve arkasında bir klorat kalıntısı bırakabilir. Belirgin bir erime noktasının olmaması, klorik asidin (HClO3) kararsızlığından kaynaklanmaktadır.
Klorik asit yoğunluğu (HClO3) g/ml
Klorik asitin (HClO3) yoğunluğu 1,97 g/cm³’tür. Yoğunluğu 1,18 g/cm³ olan hidroklorik asit gibi diğer inorganik asitlerle karşılaştırıldığında nispeten yoğun bir asittir. Klorik asidin (HClO3) yüksek yoğunluğu, asitin taşınması ve taşınmasını içeren proseslerin tasarımında önemli bir husustur.
Klorik asitin moleküler ağırlığı (HClO3)
Klorik asidin (HClO3) moleküler ağırlığı 84,46 g/mol’dür. Bu, kendisini oluşturan elementlerin atom ağırlıklarının toplamıdır: bir klor atomu, bir hidrojen atomu ve üç oksijen atomu. Klorik asidin (HClO3) moleküler ağırlığı, asit içeren çözeltilerin konsantrasyonunun ve stokiyometrisinin hesaplanmasında önemli bir parametredir.
Klorik asitin yapısı (HClO3)
Klorik asidin yapısı, üç oksijen atomuna ve bir hidrojen atomuna bağlı merkezi bir klor atomundan oluşur. Molekül, tetrahedronun merkezinde klor atomu bulunan tetrahedral bir geometriye sahiptir. Üç oksijen atomu, klor atomunun etrafında trigonal düzlemsel bir düzenlemeyle düzenlenirken, hidrojen atomu, oksijen atomlarından birine bağlanır. Klorik asidin (HClO3) yapısı, kimyasal özelliklerini ve reaktivitesini anlamak için önemlidir.
| Dış görünüş | Berrak veya sarımsı sıvı |
| Spesifik yer çekimi | 1.97 |
| Renk | Renksizden sarıya |
| Koku | Kokusuz |
| Molar kütle | 84,46 gr/mol |
| Yoğunluk | 1,68 gr/cm³ |
| Füzyon noktası | Erimeden ayrışır |
| Kaynama noktası | 40,5°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | karışabilir |
| çözünürlük | Çoğu organik çözücüde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| PKa | -0,6 |
| PH | <1 |
Klorik asit (HClO3) Güvenlik ve tehlikeler
Klorik asit (HClO3) çeşitli güvenlik riskleri taşır ve dikkatle kullanılmalıdır. Yakıtlar, indirgeyici maddeler ve yanıcı sıvılar dahil olmak üzere birçok organik maddeyle şiddetli reaksiyona girebilen güçlü bir oksidandır. Temas halinde ciltte ve gözlerde ciddi yanıklara neden olabilir ve metal yüzeylerde aşındırıcı olabilir. Buharlarının solunması solunum yolu tahrişine ve öksürüğe neden olabilir. Reaktif yapısı nedeniyle iyi havalandırılmış bir alanda, diğer kimyasallardan uzakta saklanmalı ve kullanılmalıdır. Maruz kalmayı önlemek için klorik asitle çalışırken eldiven, gözlük ve solunum cihazı gibi koruyucu ekipman giyilmelidir. Cilt veya gözle teması halinde derhal tıbbi yardıma başvurulmalıdır.
| Tehlike sembolleri | Oksitleyici ajan |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının; koruyucu ekipman giyin |
| BİR tanımlayıcılar | BM 3084 |
| HS kodu | 2811.19 |
| Tehlike sınıfı | 5.1 |
| Paketleme grubu | II |
| Toksisite | Aşındırıcı; ciltte ve gözlerde ciddi yanıklara neden olabilir |
Klorik asit (HClO3) sentezi için yöntemler
Klorik asit, klor gazının sodyum hidroksit veya sodyum klorat ile reaksiyonu dahil olmak üzere çeşitli yöntemlerle sentezlenebilir. Yaygın bir yöntem, sodyum kloratın hidroklorik asit ile reaksiyonudur.
Klorik asit sentezi reaksiyonu, iki aşamalı bir işlemde sodyum kloratın (NaClO3) hidroklorik asit (HCl) ile reaksiyonunu içerir. İlk adım, bir asit katalizörü varlığında sodyum kloratın sodyum klorite (NaClO2) ve klor dioksit (ClO2) gazına dönüştürülmesini içerir. İkinci aşamada, klor dioksit gazı, fazla hidroklorik asit ile reaksiyona girerek klorik asit ve klor gazı oluşturur.
Klorik asit sentezlemenin başka bir yöntemi, sodyum klorür, nitrik asit ve sülfürik asit içeren bir çözeltinin elektrolizini içerir. Bu işlem, suyla reaksiyona girerek klorik asit oluşturan klor gazı üretir.
Klorik asit üretmek için potasyum klorat, sülfürik asitle reaksiyona sokulabilir ve daha sonra elde edilen karışım damıtılır.
Klorik asit sentezi, şiddetli reaksiyon riski ve ilgili asitlerin aşındırıcı doğası nedeniyle reaktiflerin dikkatli bir şekilde kullanılmasını gerektirir. Uygun güvenlik protokollerine uymak ve malzemeleri iyi havalandırılan bir alanda, uygun koruyucu ekipman kullanarak kullanmak önemlidir.
Klorik asitin (HClO3) kullanım alanları
Klorik asit (HClO3), güçlü oksitleyici özelliklerinden dolayı çeşitli endüstrilerde çeşitli uygulamalara sahiptir. Kullanımlarından bazıları şunlardır:
- Diğer kimyasalların üretimi: Klorik asit, perklorik asit, kloratlar ve perkloratlar dahil olmak üzere diğer kimyasalların üretiminde bir ara madde görevi görür.
- Ağartma Maddesi: Kağıt hamuru ve kağıt endüstrisi, ağartma maddesi olarak klorik asit kullanır.
- Dezenfektan: Klorik asit, yiyecek ve içecek endüstrisinde ekipmanları ve yüzeyleri dezenfekte etmek için dezenfektan görevi görür.
- Etchant: Yarı iletken endüstrisi, istenmeyen malzeme katmanlarını yarı iletken levhalardan çıkarmak için aşındırıcı olarak klorik asit kullanır.
- Laboratuvar Reaktifi: Klorik asit, analitik kimya ve organik sentezde laboratuvar reaktifi olarak kullanılır.
- Oksitleyici madde: Klorik asit, organik kimya reaksiyonlarında oksitleyici madde olarak kullanılır.
- Roket itici gaz: Klorik asit, roket itici gazlarda oksidan görevi görür.
- Su Arıtma: Klorik asit, su arıtımında alg ve bakterilerin büyümesini kontrol etmek için kullanılır.
Sorular:
Soru: Klorik asit güçlü bir asit midir?
C: Evet, klorik asit (HClO3) güçlü bir asittir.
S: Hangi formül klorik asidi temsil eder?
Cevap: Klorik asitin formülü HClO3’tür.
Soru: HCl’nin neden hidroklorik asit ve HClO3’ün neden klorik asit olduğunu açıklayın?
C: İkili asitlerin (yalnızca iki element içeren bileşikler) adları genellikle anyonun adından türetilir; en yaygın anyon için -ic ve en az yaygın olan için -ous son eki kullanılır. HCl durumunda anyon klorürdür (Cl-), dolayısıyla asit hidroklorik asit olarak adlandırılır. HClO3 durumunda anyon klorattır (ClO3-), dolayısıyla asit klorik asit olarak adlandırılır.
Soru: Klorik asitin formülü nedir?
Cevap: Klorik asitin formülü HClO3’tür.
S: Klorik asit iyonik mi yoksa moleküler mi?
C: Klorik asit molekülerdir çünkü kovalent bağlı hidrojen, klor ve oksijen atomlarından oluşur.
