Karbonik asit (H2CO3), karbondioksit suda çözündüğünde oluşur ve okyanus pH’ının düzenlenmesinde ve kayaların hava koşullarının kontrol edilmesinde önemli bir rol oynar.
| IUPAC Adı | Karbonik asit |
| Moleküler formül | H2CO3 |
| CAS numarası | 463-79-6 |
| Eş anlamlı | Ekşi hava; Ekşi hava; H2CO3; Oksidanyumilidenmetan; Asit karbonat; hidroksiketon; Dihidroksimetanon |
| InChI | InChI=1S/CH2O3/c2-1(3)4/h(H2,2,3,4) |
Karbonik asit formülü
Karbonik asidin kimyasal formülü H2CO3’tür; bu, onun iki hidrojen atomu, bir karbon atomu ve üç oksijen atomundan oluştuğunu gösterir. Formül aynı zamanda karbonik asit içeren kimyasal reaksiyonların stokiyometrisini belirlemek için önemli olan moleküldeki atomların oranını da gösterir.
Karbonik asidin molar kütlesi
Karbonik asidin molar kütlesi yaklaşık 62.03 g/mol’dür. Karbondioksit suda çözündüğünde oluşan ve okyanusların pH’ını düzenlemekten sorumlu olan zayıf bir asittir. Karbonik asidin molar kütlesi, bir çözeltide belirli bir pH’a ulaşmak için gereken asit miktarının hesaplanması ve suda ne kadar karbondioksitin çözülebileceğinin belirlenmesi için önemlidir.
Karbonik asidin kaynama noktası
Karbonik asidin iyi tanımlanmış bir kaynama noktası yoktur çünkü kaynama noktasına ulaşmadan önce su ve karbondioksite ayrışır. Bununla birlikte, atmosferik basınçta, karbonik asit yaklaşık 333 K (60 °C) sıcaklıkta su ve karbondioksite ayrışır.
Karbonik asidin erime noktası
Karbonik asit ayrıca erime noktasına ulaşmadan önce su ve karbondioksite ayrıştığı için iyi tanımlanmış bir erime noktasına sahip değildir. Ancak atmosfer basıncında karbonik asit yaklaşık 273 K (-0,15 °C) sıcaklıkta su ve karbondioksite ayrışır.
Karbonik asit yoğunluğu g/ml
Karbonik asidin yoğunluğu oda sıcaklığında (25°C) yaklaşık 1,67 g/mL’dir. Bu değer çözeltinin konsantrasyonunun yanı sıra ortamın sıcaklığı ve basıncına bağlı olarak da değişebilmektedir.
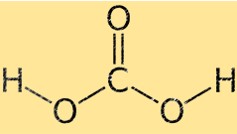
Karbonik asidin yapısı
Karbonik asit, merkezde karbon atomu ve dört yüzlünün köşelerinde yer alan dört çevreleyen atom (iki oksijen ve iki hidrojen) ile dört yüzlü bir moleküler geometriye sahiptir. İki oksijen atomu karbon atomuna çift bağlarla bağlanırken, iki hidrojen atomu tekli bağlarla bağlanır.
Karbonik asidin moleküler ağırlığı
Karbonik asidin moleküler ağırlığı 62.03 g/mol’dür. Bu değer, hidrojen (H), karbon (C) ve oksijen (O) gibi kurucu elementlerin atom ağırlıklarının eklenmesiyle hesaplanır.
| Dış görünüş | Renksiz sıvı veya kristal katı |
| Spesifik yer çekimi | 1,67 gr/cm³ |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 62,03 gr/mol |
| Yoğunluk | Oda sıcaklığında (25°C) 1,67 g/mL |
| Füzyon noktası | Yaklaşık 273 K’de (-0,15 °C) bozunur |
| Kaynama noktası | Yaklaşık 333 K’de (60°C) ayrışır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Tamamen çözünür |
| çözünürlük | Suda, etanolde, metanolde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | 3.6 (ilk ayrışma) |
| pH | 5,6 (0,1M çözümde) |
Karbonik asit Güvenlik ve tehlikeler
Karbonik asit (H2CO3) genel olarak güvenli kabul edilir ancak bazı durumlarda bazı tehlikeler oluşturabilir. H2CO3’e maruz kalmak gözlerde, ciltte ve solunum sisteminde tahrişe neden olabilir ve öksürüğe, hırıltıya ve nefes darlığına yol açabilir. H2CO3’ün yutulması mide rahatsızlığına, mide bulantısına ve kusmaya neden olabilir. H2CO3 de zayıf bir asittir ve alüminyum ve çinko gibi bazı metallerle reaksiyona girerek yanıcı hidrojen gazı üretebilir. H2CO3’ü tutarken veya kullanırken, koruyucu kıyafet giymek ve yeterli havalandırmayı da içeren uygun güvenlik önlemleri alınmalıdır. Maruz kalınması durumunda derhal tıbbi yardıma başvurulmalıdır.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Toksik olmayan |
| BM kimlik numaraları | 1824 |
| HS kodu | 28111990 |
| Tehlike sınıfı | 8 – Aşındırıcı maddeler |
| Paketleme grubu | III |
| Toksisite | Düşük toksisite |
Karbonik asit sentez yöntemleri
H2CO3 farklı yöntemlerle sentezlenebilir. Yaygın bir yöntem, karbondioksitin (CO2) suyla (H2O) bir katalizör varlığında reaksiyona sokulmasıdır. Hidrasyon adı verilen bu işlem karbonik asit üretir:
CO2 + H2O → H2CO3
Karbonik asit sentezlemenin başka bir yöntemi, kalsiyum karbonatın (CaCO3) hidroklorik asit (HCl) gibi bir asitle reaksiyona sokulmasını içerir. Asitleştirme adı verilen bu işlem karbonik asit üretir:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Oksalik asit ile sodyum karbonat (Na2CO3) gibi bir karbonat arasındaki reaksiyon, karbonik asidin sentezlenmesine olanak sağlar. Bu işlem karbonik asit ve sodyum oksalat gibi bir tuz üretir:
H2C2O4 + Na2CO3 → 2H2CO3 + Na2C2O4
Solvay prosesi, sodyum karbonatın (Na2CO3) su varlığında karbondioksit ile reaksiyonu yoluyla karbonik asit ve sodyum bikarbonat üretir.
2NaHCO3 + CO2 → Na2CO3 + H2CO3
Genel olarak, karbonik asit sentezi için her birinin kendi avantajları ve sınırlamaları olan çeşitli yöntemler mevcuttur. Yöntemin seçimi, ürünün istenen saflığı, ham maddelerin mevcudiyeti ve gerekli üretim ölçeği gibi faktörlere bağlı olacaktır.
Karbonik asitin kullanım alanları
Karbonik asit (H2CO3) endüstride, tıpta ve günlük yaşamda birçok kullanım alanı bulan çok yönlü bir bileşiktir. H2CO3’ün ana kullanımlarından bazıları şunlardır:
- Gazlı içecekler: H2CO3, soda ve bira gibi gazlı içeceklerdeki karakteristik gazdan sorumlu olan bileşiktir.
- H2CO3, su arıtma ve gıda işleme gibi çeşitli endüstriyel işlemlerde pH’ı tamponlar.
- Oksijenin yerini alarak ve yanmayı önleyerek yangını bastırır.
- H2CO3, belirli türdeki gıda ürünlerinde bakteri ve küf oluşumunu engelleyerek bunları korur.
- Özellikle mineral birikintilerini gidermek için yumuşak bir temizlik maddesi görevi görür.
- Sağlık uzmanları H2CO3’ü belirli cilt lezyonlarını tedavi etmek ve akciğer fonksiyon testleri sırasında bronşiyal daralmayı tetiklemek de dahil olmak üzere belirli uygulamalarda kullanır.
- Kaynakçılar, oksidasyonu önlemek ve daha temiz kaynaklar üretmek için H2CO3’ü koruyucu gaz olarak kullanır.
Genel olarak karbonik asit, çeşitli alanlarda geniş bir uygulama alanına sahip, kullanışlı ve çok yönlü bir bileşiktir.
Sorular:
Soru: Karbonik asit güçlü bir asit midir?
C: Karbonik asit zayıf bir asittir, yani hidrojen iyonları (H+) ve bikarbonat iyonları (HCO3-) üretmek için suda yalnızca kısmen ayrışır. Asit ayrışma sabiti (Ka) nispeten düşüktür, bu da suda tamamen ayrışmadığını gösterir.
Soru: Karbondioksit asidik midir?
C: Karbondioksit (CO2) suda hidrojen iyonları (H+) oluşturmayan nötr bir bileşik olduğundan doğası gereği asidik değildir. Ancak CO2 suda çözündüğünde su molekülleriyle reaksiyona girerek zayıf bir asit olan karbonik asit oluşturabilir. Bu reaksiyon pH’ın düşmesine neden olarak çözeltiyi daha asidik hale getirebilir. Bu nedenle CO2’nin kendisi asidik olmasa da suyla reaksiyona girdiğinde çözeltinin asitliğine katkıda bulunabilir.
