Alüminyum klorür veya AlCl3, çeşitli endüstriyel işlemlerde kullanılan kimyasal bir bileşiktir. Organik sentez ve polimerizasyon reaksiyonlarını katalize eden bir Lewis asidi görevi görür. Kişisel bakım ürünlerinde de terlemeyi önleyici özelliğe sahiptir.
| IUPAC Adı | Alüminyum triklorür |
| Moleküler formül | AlCl3 |
| CAS numarası | 7446-70-0 |
| Eş anlamlı | Alüminyum triklorür, alüminyum (III) klorür, alüminyum (III) klorür, alüminyum klorür, trikloroalüminyum |
| InChI | InChI=1S/3ClH.Al/h3*1H;/q;;;+3/p-3 |
Alüminyum Klorür Formülü
Alüminyum klorürün kimyasal formülü AlCl3’tür. Bu formül moleküldeki her bir elementin atom sayısını temsil eder. Alüminyum klorür formülü önemlidir çünkü maddeyi tanımlamak ve özelliklerini hesaplamak için kullanılır. Formül aynı zamanda bir kimyasal reaksiyonun reaktanlarını ve ürünlerini temsil etmek için kimyasal denklemlerde de kullanılır.
Alüminyum klorürün molar kütlesi
Alüminyum klorürün molar kütlesi 133,34 g/mol’dür. Bu değer, bir alüminyum atomunun ve üç klor atomunun atom kütlesinin eklenmesiyle hesaplanır. Alüminyum klorürün moleküler formülü AlCl3’tür, yani bir alüminyum atomu ve üç klor atomu içerir. Molar kütle, alüminyum klorürün önemli bir özelliğidir çünkü birçok kimyasal reaksiyonda ve endüstriyel proseste kullanılır. Molar kütle ayrıca belirli bir numunede bulunan bir maddenin miktarını hesaplamak için de kullanılır.
Alüminyum klorürün kaynama noktası
Alüminyum klorürün kaynama noktası 180,8°C’dir (357,4°F). Bu değer, alüminyum klorürün sıvı formunun gaz haline dönüştüğü sıcaklıktır. Alüminyum klorürün kaynama noktası nispeten yüksektir, bu da onu yüksek sıcaklık gerektiren birçok endüstriyel proseste faydalı kılar. Örneğin alüminyum klorür, termoplastik bir polimer olan polipropilenin üretiminde katalizör olarak kullanılır.
Alüminyum klorürün erime noktası
Alüminyum klorürün erime noktası 194°C’dir (381,2°F). Bu değer, alüminyum klorürün katı formunun sıvı duruma geçtiği sıcaklıktır. Alüminyum klorürün erime noktası nispeten düşüktür, bu da kolaylıkla eritilebileceği ve çeşitli kimyasal reaksiyonlarda ve endüstriyel işlemlerde kullanılabileceği anlamına gelir. Örneğin alüminyum klorür su arıtma endüstrisinde pıhtılaştırıcı olarak kullanılır.
Alüminyum klorür yoğunluğu g/ml
Alüminyum klorürün yoğunluğu 2,44 g/cm3’tür. Bu değer birim hacim başına alüminyum klorürün kütlesidir. Alüminyum klorürün yoğunluğu önemlidir çünkü maddenin belirli bir hacminin kütlesini belirler. Alüminyum klorürün yoğunluğu aynı zamanda bir çözeltideki maddenin konsantrasyonunu hesaplamak için de kullanılır.
Alüminyum klorür yapısı
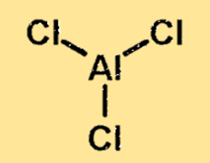
Alüminyum klorürün yapısı, bir alüminyum atomu ve üç klor atomu ile kovalent bağlı bir moleküldür. Alüminyum atomu molekülün merkezinde bulunur ve üç klor atomu ile çevrilidir. Alüminyum klorürün yapısı önemlidir çünkü maddenin fiziksel ve kimyasal özelliklerini belirler.
Alüminyum Klorürün Molekül Ağırlığı
Alüminyum klorürün moleküler ağırlığı 133,34 g/mol’dür. Bu değer moleküldeki atomların atom ağırlıklarının toplamıdır. Alüminyum klorürün moleküler ağırlığı önemlidir çünkü belirli bir numunede bulunan bir maddenin miktarını hesaplamak için kullanılır. Bu değer aynı zamanda bir çözeltinin molar konsantrasyonunu belirlemek için de kullanılır.
| Dış görünüş | Beyaz ila sarı katı veya toz |
| Spesifik yer çekimi | 2,44 gr/cm3 |
| Renk | Renksizden soluk sarıya |
| Koku | Kokusuz |
| Molar kütle | 133,34 gr/mol |
| Yoğunluk | 2,44 gr/cm3 |
| Füzyon noktası | 194°C (381,2°F) |
| Kaynama noktası | 180,8°C (357,4°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suda çok çözünür |
| çözünürlük | Etanol, metanol ve eterde çözünür |
| Buhar basıncı | 25°C’de 2,67 kPa |
| Buhar yoğunluğu | 4,45 (hava = 1) |
| pKa | -6 |
| pH | 2,0 (10 g/L, H2O) |
Alüminyum klorürün güvenliği ve tehlikeleri
Alüminyum klorür çeşitli güvenlik ve sağlık riskleri oluşturur. Aşındırıcıdır ve yutulduğunda veya solunduğunda ciddi cilt ve göz tahrişinin yanı sıra solunum ve sindirim sistemi tahrişine de neden olabilir. Ayrıca cilt ile teması halinde yanıklara neden olabilir. Alüminyum klorür güçlü bir oksitleyici maddedir ve suyla şiddetli reaksiyona girerek hidrojen klorür gazı açığa çıkarabilir. Ayrıca alkoller ve aminler gibi birçok organik bileşikle de uyumsuzdur ve onlarla reaksiyona girerek tehlikeli gazlar üretebilir. Alüminyum klorürle çalışırken eldiven, gözlük ve solunum cihazı dahil uygun koruyucu ekipman giyilmelidir.
| Tehlike sembolleri | Aşındırıcı, zararlı |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının. Koruyucu eldiven ve göz/yüz koruması kullanın. Temas halinde bol su ile yıkayıp doktora başvurunuz. Yutmayın veya solumayın. İyi havalandırılan bir ortamda kullanınız. Uyumsuz malzemelerden uzakta, serin ve kuru bir yerde saklayın. |
| BM kimlik numaraları | BM 1726 |
| HS kodu | 2827.32.00 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | III |
| Toksisite | Yutulması veya solunması halinde toksiktir. Ciddi cilt ve göz tahrişine neden olur. Solunum ve sindirim yollarında tahrişe neden olabilir. Suyla şiddetli reaksiyona girerek hidrojen klorür gazı açığa çıkarabilir. Alkoller ve aminler gibi birçok organik bileşikle uyumsuzdur ve bunlarla reaksiyona girerek tehlikeli gazlar oluşturabilir. |
Alüminyum klorür sentezi için yöntemler
Alüminyum klorür, doğrudan sentez, hidroliz ve alüminyumun hidrojen klorür ile reaksiyonu gibi çeşitli yöntemlerle sentezlenebilir.
- Doğrudan sentez, alüminyumun yüksek sıcaklıklarda, genellikle 700-800°C civarında, klor gazı ile reaksiyonunu içerir. Alüminyumun hidrojen klorür ile reaksiyonu, gaz fazında sıvı formda yoğunlaştırılabilen alüminyum klorür üretir.
- Hidroliz, metalik alüminyumun hidroklorik asit veya suyla reaksiyona girerek hidrojen gazı ve alüminyum klorür üretmesini içerir. Hidroliz reaksiyonu genellikle ekzotermiktir ve doğru şekilde gerçekleştirilmezse tehlikeli olabilir.
- Alüminyumun hidrojen klorür gazı ile reaksiyonu, alüminyum klorürün sentezlenmesinin başka bir yöntemidir. Bu reaksiyon oda sıcaklığında gerçekleşir ve hidrojen gazı ve alüminyum klorür üretir.
- Alüminyum klorürü sentezlemenin bir başka yaygın yöntemi, alüminyum oksidin hidroklorik asitle reaksiyona sokulmasıdır. Bu reaksiyon ürün olarak alüminyum klorür ve su üretir.
- Alüminyumun bir klor gazı ve karbon monoksit karışımı ile reaksiyona sokulması, alüminyum klorürün sentezlenmesinin başka bir yöntemidir. Bu reaksiyon yüksek sıcaklıklarda meydana gelir ve alüminyum klorür ve karbondioksit üretir.
Genel olarak, alüminyum klorürün sentezi, güvenli ve verimli bir proses sağlamak için dikkatli bir şekilde ele alınmasını ve reaksiyon koşullarının kontrol edilmesini gerektirir.
Alüminyum Klorürün Kullanım Alanları
Alüminyum klorür benzersiz özelliklerinden dolayı çeşitli endüstrilerde birçok kullanıma sahiptir.
- Polimerlerin, farmasötiklerin ve parfümlerin üretimini de içeren organik kimya reaksiyonlarında genellikle katalizör olarak alüminyum klorür kullanılır.
- İçme suyunun ve atık suyun askıdaki katı maddeleri uzaklaştırmak için arıtılması genellikle pıhtılaştırıcı olarak alüminyum klorürün kullanılmasını içerir.
- Alüminyum ve alaşım üretimi, yabancı maddelerin giderilmesine ve döküm prosesinin iyileştirilmesine yardımcı olan, eritken olarak alüminyum klorürün kullanılmasından yararlanır.
- Petrokimya endüstrisinde alüminyum klorür, benzin ve diğer hidrokarbonların üretiminde katalizör görevi görür. Ayrıca kişisel bakım ürünlerinde deodorant ve terlemeyi önleyici olarak da kullanılmaktadır.
- Reçetesiz satılan bazı ilaçlar, küçük cilt tahrişlerini tedavi etmek ve kanamayı durdurmak için büzücü özelliklere sahip alüminyum klorür kullanır. Alüminyum klorür ayrıca aşırı terleme ile karakterize bir durum olan hiperhidrozu tedavi etmek için de kullanılır.
- Tekstil endüstrisi, boyaların kumaşlara tutunmasına yardımcı olmak için mordan olarak alüminyum klorür kullanır ve aynı zamanda sentetik kauçuk üretiminde de kullanılır.
Genel olarak, alüminyum klorür birçok endüstride çeşitli ve önemli kullanım alanları bularak modern dünyadaki önemini vurgulamaktadır.
Sorular:
S: Hangisi 1 mol sodyum klorürü 1 mol alüminyum klorürle karşılaştırır?
A: 1 mol sodyum klorür (NaCl) ve 1 mol alüminyum klorürün (AlCl3) her ikisi de 1 mol klorür iyonu içerir, ancak alüminyum klorür, sodyum klorürden üç kat daha fazla katyon içerir.
S: Alüminyum klorür sulu mu?
C: Alüminyum klorür katı ve sulu formda bulunabilir. Suda çözündüğünde alüminyum katyonunun hidrolizi nedeniyle çok asidik bir çözelti oluşturur.
S: Alüminyum klorürün doğru formülü nedir?
C: Alüminyum klorürün doğru formülü AlCl3’tür. Bu, her alüminyum klorür molekülünün bir alüminyum katyonu (Al3+) ve üç klorür anyonu (Cl-) içerdiğini gösterir.
S: Alüminyum klorür güvenli midir?
C: Alüminyum klorür, doğru şekilde kullanılmazsa tehlikeli olabilir. Ciltte ve gözde tahrişe, solunum ve sindirim sisteminde tahrişe neden olabilir ve yutulması veya solunması halinde toksik olabilir. İyi havalandırılmış bir alanda ve uygun koruyucu ekipmanla saklanmalı ve kullanılmalıdır.
Soru: 1,50 mol alüminyum klorürde kaç tane klorür iyonu vardır?
C: Alüminyum klorürün formülü AlCl3 olduğundan her molekül üç klorür iyonu içerir. Dolayısıyla 1,50 mol alüminyum klorür, 1,50 x 3 = 4,50 mol klorür iyonu içerir.
