Amonyum klorür veya NH4Cl, ilaç ve gübre de dahil olmak üzere çeşitli uygulamalarda kullanılan beyaz kristalli bir tuzdur. Amonyak ve hidroklorik asitin reaksiyonu sonucu oluşur ve belirgin bir tuzlu tada sahiptir.
| IUPAC Adı | Amonyum Klorür |
| Moleküler formül | NH4Cl |
| CAS numarası | 12125-02-9 |
| Eş anlamlı | Sal amonyak, Salmiac, Nushadir tuzu, Amchlor, Sal armagnac, Hidroklorat, Amonyum muriat, Sal armagnac |
| InChI | InChI=1S/ClH.H3N/h1H;1H3 |
NH4Cl molar kütlesi
Amonyum klorürün molar kütlesi 53,49 g/mol’dür. Molar kütle, bir maddenin bir molünün kütlesini ifade eder ve mol başına gram (g/mol) cinsinden ifade edilir. Amonyum klorürün molar kütlesi, onu oluşturan atomların nitrojen (N), hidrojen (H) ve klor (Cl) atomik kütlelerinin eklenmesiyle belirlenir. Amonyum klorürün moleküler formülü NH4Cl’dir; bu, bir nitrojen atomu, dört hidrojen atomu ve bir klor atomu içerdiği anlamına gelir. Bu nedenle amonyum klorürün molar kütlesi şu şekilde hesaplanabilir:
Molar kütle = (1 x N’nin atom kütlesi) + (4 x H’nin atom kütlesi) + (1 x Cl’nin atom kütlesi)
= (1 x 14,01 g/mol) + (4 x 1,01 g/mol) + (1 x 35,45 g/mol)
= 53,49 gr/mol
Amonyum klorürün kaynama noktası
Amonyum klorürün kaynama noktası 520°C’dir (968°F). Kaynama noktası, bir sıvının buhar basıncının, ona uygulanan dış basınca eşit olduğu sıcaklıktır. Bu sıcaklıkta amonyum klorür buharlaşır ve gaz haline dönüşür. Amonyum klorürün yüksek kaynama noktası, amonyum (NH4+) ve klorür (Cl-) iyonları arasındaki güçlü iyonik bağlardan kaynaklanmaktadır.
Amonyum klorürün erime noktası
Amonyum klorürün erime noktası 338°C’dir (640°F). Erime noktası bir katının sıvıya dönüştüğü sıcaklıktır. Bu sıcaklıkta amonyum (NH4+) ve klorür (Cl-) iyonları arasındaki iyonik bağlar kırılır ve amonyum klorür katı halden sıvı hale dönüşür. Amonyum klorür, diğer iyonik bileşiklerle karşılaştırıldığında nispeten düşük bir erime noktasına sahiptir, bu da onu kaynak ve metalurji gibi belirli uygulamalarda faydalı kılar.
Amonyum klorür yoğunluğu g/ml
Amonyum klorürün yoğunluğu 1,527 g/cm³’tür. Yoğunluk, bir maddenin birim hacmi başına kütle miktarının bir ölçüsüdür. Amonyum klorürün yüksek yoğunluğu, çok kompakt iyonik kafes yapısından kaynaklanmaktadır. Amonyum klorürün yoğunluğu sudan daha yüksektir, bu da onun suda batacağı anlamına gelir.
Amonyum klorürün moleküler ağırlığı
Amonyum klorürün moleküler ağırlığı 53,49 g/mol’dür. Molekül ağırlığı, bir moleküldeki tüm atomların atom ağırlıklarının toplamıdır. Amonyum klorürün moleküler ağırlığı, molar kütlesiyle aynıdır.
Amonyum klorürün yapısı
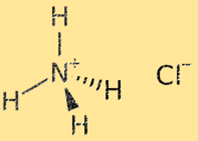
Amonyum klorürün yapısı, alternatif amonyum (NH4+) ve klorür (Cl-) iyonlarından oluşan bir kristal kafestir. Amonyum iyonu, bir nitrojen atomu ve dört hidrojen atomundan oluşan, pozitif yüklü (+1) çok atomlu bir iyondur. Klorür iyonu, bir klor atomundan oluşan, negatif yüklü (-1) tek atomlu bir iyondur. Amonyum klorürün kristal kafes yapısı, amonyum ve klorür iyonları arasındaki güçlü iyonik bağlarla stabilize edilir ve sonuçta çok kararlı ve kırılgan bir katı elde edilir.
Amonyum Klorür Formülü
Amonyum klorürün formülü NH4Cl’dir. Bir amonyum iyonu (NH4+) ve bir klorür iyonundan (Cl-) oluşur. Formül, bir moleküldeki atomların oranını temsil eder ve her amonyum iyonuna karşılık bir klorür iyonu bulunduğunu gösterir. Amonyum klorür formülü, bileşiğin molar kütlesini, yoğunluğunu ve diğer özelliklerini belirlemek için kullanılır.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 1.527 gr/cm³ |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 53,49 gr/mol |
| Yoğunluk | 1.527 gr/cm³ |
| Füzyon noktası | 338°C (640°F) |
| Kaynama noktası | 520°C (968°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 29,7g/100ml (25°C) |
| çözünürlük | Etanol ve asetonda çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| PKa | sabah 9:25. |
| pH | 4,6 (%5 çözüm) |
Amonyum klorürün güvenliği ve tehlikeleri
Amonyum klorür (NH4Cl) genellikle normal kullanım için güvenli kabul edilir. Ancak büyük miktarlarda yutulması veya solunması halinde zararlı olabilir. NH4Cl’nin yutulması ağız ve boğaz tahrişine, mide bulantısına, kusmaya ve ishale neden olabilir. NH4Cl’nin solunması solunum sisteminde tahrişe, öksürüğe ve nefes darlığına neden olabilir. NH4Cl cilt ve göz tahrişine neden olabileceğinden dikkatli kullanılmalıdır. Gözleri, burnu ve boğazı tahriş edebilecek NH4Cl tozuna veya buharına maruz kalmaktan kaçınmak da önemlidir. NH4Cl ile çalışırken eldiven ve gözlük gibi uygun kişisel koruyucu ekipmanlar giyilmelidir.
| Tehlike sembolleri | XI |
| Güvenlik Açıklaması | S22, S24/25, S36/37/39 |
| BM kimlik numaraları | BM 3077 |
| HS kodu | 2827.10.00 |
| Tehlike sınıfı | 9 – Çeşitli tehlikeli mallar |
| Paketleme grubu | III |
| Toksisite | Düşük toksisiteye sahiptir ancak büyük miktarlarda yutulması veya solunması halinde zararlı olabilir. |
Amonyum klorür sentezi için yöntemler
Amonyum klorür (NH4Cl) çeşitli yöntemlerle sentezlenebilir.
- Yaygın bir yöntem, amonyak gazının sudaki hidroklorik asitle reaksiyona sokulmasıdır. Bu ekzotermik reaksiyon, beyaz kristalli bir katı formunda NH4Cl üretir. Ortaya çıkan ısının sıçramasını önlemek için hidroklorik asidi suya yavaşça karıştırırken eklemek önemlidir.
- NH4Cl üretmenin başka bir yöntemi, sodyum karbonat üretimi veya Solvay işlemi gibi çeşitli endüstriyel işlemlerin bir yan ürünüdür.
- NH4Cl’yi sentezlemenin başka bir yolu amonyağı sodyum klorürle reaksiyona sokmaktır. Bu reaksiyon hem NH4Cl hem de sodyum hidroksit üretir. Bu reaksiyon ekzotermiktir ve istenmeyen yan ürünlerin oluşumunu önlemek için dikkatli kontrol gerektirir.
Amonyum Klorürün Kullanım Alanları
Amonyum klorürün (NH4Cl) farklı endüstrilerde birçok kullanımı vardır.
- NH4Cl, tarımda gübre görevi görerek mahsullere nitrojen ve klorür gibi temel besinleri sağlayarak verimi ve kaliteyi artırır.
- Amonyum klorür, bir elektrolit olarak elektriği ileterek kuru hücrelerin düzgün çalışmasını kolaylaştırır.
- Tekstil endüstrisi, boyaların kumaşlara sabitlenmesine ve renk haslığının arttırılmasına yardımcı olan bir boyama ve baskı maddesi olarak NH4Cl’yi kullanır.
- Metal işleme ve lehimlemede bir akış maddesi olarak NH4Cl, metallerdeki oksit katmanlarını gidererek kaynaklamayı kolaylaştırır.
- Kimyasalın gıda, ilaç ve kozmetikte tatlandırıcı madde, öksürük ilaçlarında balgam söktürücü ve kişisel bakım ürünlerinde bileşen olarak uygulamaları vardır.
Genel olarak, NH4Cl’nin benzersiz özellikleri, onu farklı endüstrilerde birçok önemli uygulamaya sahip çok yönlü bir kimyasal haline getirmektedir.
Sorular:
Soru: Amonyum klorür süblim midir?
C: Evet, amonyum klorürün süblimleştiği bilinmektedir, yani katı fazdan, arada erimeden doğrudan gaz fazına geçebilir.
S: NH4Cl asidik mi yoksa bazik mi?
Cevap: Amonyum klorür asidik bir tuzdur. Suda çözündüğünde hidrolize uğrayarak asidik bir çözelti oluşturabilir. Bunun nedeni, amonyum iyonunun zayıf bir asit gibi davranması ve su moleküllerine bir proton (H+) bağışlamasıdır.
Soru: Amonyum klorürün formülü nedir?
C: Amonyum klorürün formülü NH4Cl’dir. İyonik bağlarla bir arada tutulan bir amonyum iyonu (NH4+) ve bir klorür iyonundan (Cl-) oluşur.
Soru: Amonyum klorür suda çözünür mü?
C: Evet, amonyum klorür suda oldukça çözünür. Oda sıcaklığında 100 mililitre suda yaklaşık 29,7 gram amonyum klorür çözülebilir.
S: Amonyum klorür ve sodyum klorür nasıl ayrılır?
C: Amonyum klorür ile sodyum klorürü ayırmanın bir yolu süblimasyondur. Bu, karışımın ısıtılmasıyla, amonyum klorürün süblimleşmesine ve sodyum klorürün katı formda kalmasına neden olunarak başarılabilir. Süblimleştirilmiş amonyum klorür daha sonra toplanabilir ve katı bir forma dönüştürülebilir. Başka bir yöntem, karışımın suda çözülmesi ve daha sonra belirli bir reaktif veya pH ayarlaması kullanılarak tuzlardan birinin seçici olarak çökeltilmesidir.
