Klor triflorür veya ClF3, roket yakıtlarında, temizlik maddelerinde ve kimyasal reaksiyonlarda oksitleyici bir madde olarak kullanılan oldukça reaktif ve toksik bir kimyasal bileşiktir. Organik maddelerle teması halinde ciddi yanıklara neden olabilir ve kendiliğinden tutuşabilir.
| IUPAC Adı | Klor triflorür |
| Moleküler formül | ClF3 |
| CAS numarası | 7790-91-2 |
| Eş anlamlı | Klor florür, Trifloroklor, Trikloroflorür, Floroklor, Kloril florür, Flor klorür |
| InChI | InChI=1S/ClF3/c2-1(3)4 |
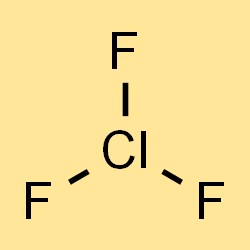
Klor triflorür formülü
Klor triflorürün kimyasal formülü, moleküldeki üç flor atomunu ve bir klor atomunu temsil eden ClF3’tür. Formül, klor triflorürün molar kütlesini, yoğunluğunu ve diğer fiziksel özelliklerini hesaplamak için kullanılabilir. Formül aynı zamanda bileşikte bulunan atomların türlerini ve sayısını da gösterir; bu, bileşiğin kimyasal özelliklerini ve reaktivitesini anlamak için önemlidir.
Klor Triflorür molar kütlesi
Klor triflorürün (ClF3) molar kütlesi 92,45 g/mol’dür. Bu değer, klor için 35,45 g/mol ve flor için 37,996 g/mol olan kurucu elementlerin atom ağırlıklarının eklenmesiyle hesaplanır. Klor triflorürün molar kütlesi, kimyasal hesaplamalarda ve belirli bir numunedeki bileşiğin miktarının belirlenmesinde önemlidir.
Klor triflorürün kaynama noktası
Klor triflorürün standart basınçta kaynama noktası 11,75°C’dir. Bu, onu kolayca buharlaşabilen ve zehirli dumanlar oluşturabilen uçucu ve oldukça reaktif bir bileşik haline getirir. Klor triflorürün düşük kaynama noktası, molekülleri arasındaki zayıf moleküller arası kuvvetlere atfedilir ve bu onların parçalanmasına ve nispeten düşük sıcaklıklarda gaz olarak kaçmasına olanak tanır.
Klor triflorürün erime noktası
Klor triflorürün standart basınçta -76,3°C (-105,3°F) erime noktası vardır. Bu, onu oda sıcaklığında ve basınçta katı hale getirir, ancak yüksek uçuculuğu nedeniyle kolaylıkla süblimleşebilir ve zehirli dumanlar oluşturabilir. Klor triflorürün düşük erime noktası, molekülleri arasındaki zayıf moleküller arası kuvvetlere atfedilir; bu da onların nispeten düşük sıcaklıklarda parçalanmasına ve gaz haline gelmesine olanak tanır.
Klor triflorürün yoğunluğu g/ml
Klor triflorürün yoğunluğu standart sıcaklık ve basınçta (STP) 1,77 g/mL’dir. Bu değer havanınkinden (1,29 g/mL) daha yüksektir, bu da klor triflorürün havadan daha yoğun bir gaz olmasını sağlar. Klor triflorürün yüksek yoğunluğu, atmosferdeki çoğu gazınkinden daha yüksek olan moleküler ağırlığından kaynaklanmaktadır.
Klor triflorürün moleküler ağırlığı
Klor triflorürün moleküler ağırlığı 92,45 g/mol’dür. Bu değer, klor için 35,45 g/mol ve flor için 37,996 g/mol olan kurucu elementlerin atom ağırlıklarının eklenmesiyle hesaplanır. Klor triflorürün yüksek moleküler ağırlığı, onu havadan daha ağır, yoğun bir gaz haline getirir.
Klor triflorürün yapısı
Klor triflorür, ekvator konumlarında üç flor atomuna bağlı merkezi bir klor atomu ve eksenel konumlarda iki boş alan içeren, trigonal bipiramidal bir moleküler geometriye sahiptir. Bu yapı, iki eksenel konumun kısmi pozitif yüke sahip olduğu ve üç ekvator konumunun kısmi negatif yüke sahip olduğu polar bir molekülün ortaya çıkmasına neden olur.
| Dış görünüş | Renksizden soluk sarıya kadar gaz veya sıvı |
| Spesifik yer çekimi | 1.77 |
| Renk | Renksizden soluk sarıya |
| Koku | Keskin ve boğucu bir koku |
| Molar kütle | 92,45 gr/mol |
| Yoğunluk | STP’de 1,77 g/mL |
| Füzyon noktası | -76,3°C (-105,3°F) |
| Kaynama noktası | 11.75°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suyla şiddetli reaksiyona girer |
| çözünürlük | Sülfürik asit, nitrik asit ve diğer oksitleyici maddelerde çözünür |
| Buhar basıncı | 20°C’de 1,73 ATM |
| Buhar yoğunluğu | 3,2 (hava = 1) |
| PKa | Uygulanamaz |
| pH | Uygulanamaz |
Klor triflorürün güvenliği ve tehlikeleri
Klor triflorür oldukça reaktif ve tehlikeli bir bileşiktir. Bu ciddi sağlık ve güvenlik riskleri doğurur ve son derece dikkatli bir şekilde ele alınmalıdır. Cilt, göz ve mukoza ile teması halinde ciddi yanıklara, korozyona ve tahrişe neden olabilir. Buharlarının solunması solunum sıkıntısına, öksürüğe ve göğüs ağrısına neden olabilir. Klor triflorür ayrıca organik maddeler, metaller ve suyla tutuşup şiddetli reaksiyona girerek patlamalara ve yangınlara neden olabilir. Klor triflorürle çalışırken kimyasallara dayanıklı giysiler ve solunum maskeleri gibi özel koruyucu ekipmanlar giyilmeli ve bunlar yalnızca eğitimli profesyoneller tarafından kontrol edilen, iyi havalandırılan bir ortamda kullanılmalıdır.
| Tehlike sembolleri | Aşındırıcı, Oksitleyici |
| Güvenlik Açıklaması | Isıdan, kıvılcımdan, açık alevden, sıcak yüzeylerden ve tutuşturucu kaynaklardan uzak tutun. Koruyucu kıyafet ve ekipman giyin. Cilt, göz ve giysilerle temasından kaçının. Dumanı veya buharı solumayın. Yemeyin. Sadece iyi havalandırılmış bir ortamda kullanın. |
| BİR tanımlayıcılar | 1749 |
| HS kodu | 281211 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | BEN |
| Toksisite | Çok zehirli |
Klor triflorürün sentezi için yöntemler
Klor gazının doğrudan florlanması, klor triflorürü sentezleyebilir. Hidrojen florür ve klor gazı, klor triflorürü sentezlemek için reaksiyona girebilir.
Klor gazı ve flor gazı karışımı, doğrudan florlama yönteminde klor triflorür üretmek için aktif karbon veya başka bir inert malzeme yatağında yüksek sıcaklıkta reaksiyona girer.
Başka bir yöntem, hidrojen florür ile klor gazı arasındaki reaksiyonu içerir. Bu yöntemde her iki gaz da yüksek sıcaklıklarda aktifleştirilmiş alümina veya platin gibi bir katalizörün üzerinden geçer. İki gaz arasındaki reaksiyon, yan ürünler olarak klor triflorür ve hidrojen klorür üretir.
Kükürt tetraflorür ve klor gazı, demir veya nikel gibi bir katalizör varlığında yüksek sıcaklıklarda reaksiyona girerek klor triflorürü sentezler ve bir yan ürün olarak kükürt dioksit üretir.
Klor triflorürün tehlikeli yapısından dolayı bu yöntemlerin her biri için özel ekipman ve dikkatli kullanım gereklidir. Sentez işlemi sırasında kimyasallara dayanıklı giysiler ve havalandırma sistemleri gibi uygun güvenlik önlemleriyle personelin ve çevrenin güvenliği sağlanmalıdır.
Klor triflorürün kullanım alanları
Klor triflorür (ClF3), yüksek reaktif doğası ve güçlü oksitleyici özellikleri nedeniyle çeşitli endüstriyel uygulamalara sahiptir.
- ClF3, silikon ve germanyum gibi yarı iletken malzemeleri yüzeylerinden istenmeyen kirleticileri ve yabancı maddeleri çıkararak temizler ve aşındırır.
- ClF3, nükleer yakıt üretimi için uranyum oksidi uranyum heksaflorüre dönüştürür. Uranyum hekzaflorür nükleer reaktörlerde kullanılmak üzere zenginleştirilmiştir.
- ClF3, roket itici gazlarında ve yakıt sistemleri için yüksek enerjili oksitleyicilerde hidrazin veya hidrojen gibi diğer oksitleyici maddelerle birlikte kullanıldığında yanma verimliliğini artırır ve daha fazla itme kuvveti üretir.
- ClF3 tekstil ve kağıt ürünlerini beyazlatır.
- ClF3, flor gazı ve florokarbonlar gibi bazı kimyasallar üretir.
Tehlikeli doğasından dolayı, klor triflorür tüm uygulamalarında son derece dikkatli bir şekilde ve yalnızca uygun güvenlik ekipmanı ve protokollerine sahip eğitimli profesyoneller tarafından kullanılmalıdır.
Sorular:
S: Klor triflorür polar mı yoksa polar değil mi?
C: Klor triflorür, klor ve flor atomları arasındaki elektronegatiflik farkından dolayı polar bir moleküldür.
S: Klor triflorür nasıl söndürülür?
C: Klor triflorür kuru kum, grafit veya sodyum klorür kullanılarak söndürülebilir. Şiddetli reaksiyona girebileceğinden ve zehirli gazlar açığa çıkarabileceğinden, klor triflorür yangınını söndürmek için asla su kullanılmamalıdır.
S: Klor triflorürün Lewis yapısı?
C: ClF3’ün Lewis yapısı, üç flor atomu ile çevrelenmiş merkezi bir klor atomundan oluşur. Klor atomu, üç flor atomunun her birine tek bir bağla bağlıdır ve klor atomunda tek bir elektron çifti vardır.
S: Klor triflorür molekülündeki klor atomunun resmi yükü nedir?
A: Klor triflorürdeki klor atomunun formal yükü sıfırdır. Klor atomunun yedi değerlik elektronu vardır ve elektronegatifliği klordan daha yüksek olan üç flor atomuna bağlıdır. Klor atomundaki yalnız elektron çifti herhangi bir bağa dahil değildir ve bu nedenle resmi yükün belirlenmesinde dikkate alınmaz.
S: Klor triflorür yangını mı?
C: Klor triflorür, organik maddelerle ve hatta havayla teması halinde kendiliğinden tutuşabilen oldukça reaktif ve yanıcı bir maddedir. Klor triflorür yangını durumunda yangını söndürmek için kuru kum, grafit veya sodyum klorür kullanılmalı, şiddetli reaksiyona neden olabileceğinden kesinlikle su kullanılmamalıdır. Klor triflorür yangını durumunda bölgeyi boşaltmak ve maruz kalma durumunda derhal tıbbi yardım istemek de çok önemlidir.
