Baryum hidroksit, Ba(OH)2 formülüne sahip kimyasal bir bileşiktir. Suda oldukça çözünür olan ve laboratuvarlarda ve endüstriyel işlemlerde yaygın olarak kullanılan beyaz kristalli bir katıdır.
| IUPAC Adı | Baryum dihidroksit |
| Moleküler formül | Ba(OH)2 |
| CAS numarası | 17194-00-2 |
| Eş anlamlı | Baryum (II) hidroksit, barit, baryum hidrat, baryum dihidrat, bis (baryum hidroksit), bis (oksidanil) baryum hidrat |
| InChI | InChI=1S/Ba.2H2O/h;2*1H2/q+2;;/p-2 |
Baryum hidroksitin molar kütlesi
Baryum hidroksitin molar kütlesi 171,34 g/mol’dür. Her birinin molar kütlesi sırasıyla 137,33 g/mol ve 17,01 g/mol olan bir baryum iyonu (Ba2+) ve iki hidroksit iyonundan (OH-) oluşur. Baryum hidroksitin molar kütlesi, reaksiyonlar için gerekli bileşiğin miktarını belirlemek veya bir çözeltinin konsantrasyonunu hesaplamak için önemlidir.
Baryum Hidroksit Formülü
Baryum hidroksitin kimyasal formülü Ba(OH)2’dir. Bir baryum iyonu (Ba2+) ve iki hidroksit iyonundan (OH-) oluşur. Baryum hidroksit formülü, reaksiyonlarda ihtiyaç duyulan bileşik miktarının belirlenmesi veya bir çözeltinin konsantrasyonunun hesaplanması için önemlidir. Ayrıca bileşiğin yapısını ve çözeltideki davranışını temsil etmek için de kullanılır.
Ba(OH)2’nin kaynama noktası
Ba(OH)2’nin kaynama noktası iyi tanımlanmamıştır çünkü kaynatılmadan önce ayrışır. Ba(OH)2 güçlü bir bazdır ve havadaki karbondioksitle kolayca reaksiyona girerek baryum karbonat ve su oluşturur. Ba(OH)2’nin ayrışma sıcaklığı çözeltinin konsantrasyonuna bağlıdır ancak genellikle 780°C’nin üzerindedir.
Ba(OH)2 erime noktası
Ba(OH)2’nin erime noktası 407°C’dir. Beyaz, kokusuz kristaller halinde katı halde bulunur. Ba(OH)2 ısıtıldığında tersinir bir reaksiyona girerek baryum oksit ve su oluşturur. Ba(OH)2’nin erime noktası, güvenli bir şekilde işlenebileceği ve depolanabileceği sıcaklığın belirlenmesinde önemlidir.
Ba(OH)2 yoğunluğu g/ml
Katı Ba(OH)2’nin yoğunluğu 3,22 g/cm3’tür. Çözeltide yoğunluk, konsantrasyona bağlı olarak değişir. Örneğin %10’luk bir Ba(OH)2 çözeltisinin yoğunluğu 1,17 g/cm3’tür. Ba(OH)2’nin yoğunluğu, reaksiyonlar için gerekli olan çözeltinin hacminin belirlenmesinde veya bileşiğin işlenmesinde önemlidir.
Ba(OH)2 molekül ağırlığı
Ba(OH)2’nin moleküler ağırlığı 171,34 g/mol’dür. Bir baryum iyonu ve iki hidroksit iyonunun atom ağırlıklarının toplamıdır. Ba(OH)2’nin moleküler ağırlığı, reaksiyonlarda ihtiyaç duyulan bileşik miktarının belirlenmesi veya bir çözeltinin konsantrasyonunun hesaplanması için önemlidir.
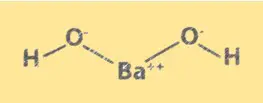
Yapı Ba(OH)2
Ba(OH)2, sodyum klorüre benzer bir kristal yapıya sahiptir. Kübik bir kafes şeklinde düzenlenmiş Ba2+ iyonları ve OH- iyonlarından oluşur. Ba2+ iyonları küpün köşelerini, OH- iyonları ise her yüzün merkezini işgal eder. Ba(OH)2’nin yapısı, kimyasal özelliklerini ve çözeltideki davranışını anlamak için önemlidir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 3,22 g/cm3 (katı) |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 171,34 gr/mol |
| Yoğunluk | 2,18 g/cm3 (sulu çözelti, 25°C’de %10 a/a) |
| Füzyon noktası | 407°C |
| Kaynama noktası | Kaynamadan önce parçalanır |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suda çok çözünür |
| çözünürlük | Alkol ve asetonda çözünür |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Alkali (pH > 7) |
Not: Bu tabloda verilen değerler genel açıklamalar olup, maddenin özel koşullarına ve konsantrasyonlarına bağlı olarak değişiklik gösterebilir.
Baryum Hidroksit Güvenliği ve Tehlikeleri
Ba(OH)2 ciltte, gözlerde ve solunum yollarında ciddi tahrişe neden olabilen oldukça yakıcı ve toksik bir maddedir. Dikkatli bir şekilde kullanılması ve eldiven ve koruyucu gözlük gibi uygun kişisel koruyucu ekipmanların kullanılması önemlidir. Solunması veya yutulması halinde akciğerlerde, sindirim sisteminde ve böbreklerde ciddi hasara neden olabilir. Asitler ve oksidanlar gibi uyumsuz maddelerden uzakta, serin, kuru, iyi havalandırılmış bir alanda saklanmalıdır. Dökülme veya maruz kalma durumunda, alanı boşaltmak ve derhal tıbbi yardım istemek gibi uygun acil durum prosedürlerini izleyin.
| Tehlike sembolleri | Aşındırıcı |
| Güvenlik Açıklaması | Cilt ve gözlerle temasından kaçının; Koruyucu kıyafet ve eldiven giyin; Yalnızca iyi havalandırılan alanlarda kullanın |
| BİR tanımlayıcılar | BM 1564 |
| HS kodu | 2816.40.00 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | II |
| Toksisite | Yutulması, solunması ve cilt tarafından emilmesi halinde toksiktir; Ciddi cilt ve göz tahrişine neden olur; Solunum yolu tahrişine ve böbrek hasarına neden olabilir |
Baryum hidroksitin sentezi için yöntemler
Ba(OH)2, baryum oksidin (BaO) su (H2O) ile reaksiyonu veya baryum klorürün (BaCl2) sodyum hidroksit (NaOH) ile reaksiyonu dahil olmak üzere çeşitli yöntemlerle sentezlenebilir.
Birinci yöntemde baryum oksit, damıtılmış suya, istenilen konsantrasyona ulaşılıncaya kadar sürekli karıştırılarak yavaş yavaş eklenir. Elde edilen çözelti daha sonra filtrelenir ve kurutularak Ba(OH)2’nin katı formu elde edilir.
İkinci yöntemde, bir baryum klorür çözeltisi, bir sodyum hidroksit çözeltisine, istenen pH’a ulaşılıncaya kadar sürekli karıştırılarak yavaş yavaş eklenir. Elde edilen çözelti daha sonra filtrelenir ve kurutularak Ba(OH)2’nin katı formu elde edilir.
Başka bir yöntem, baryum sülfürün (BaS) suyla reaksiyona sokularak Ba(OH)2 ve hidrojen sülfür gazı (H2S) üretilmesini içerir.
Ba(OH)2 ayrıca erimiş baryum tuzlarının elektrolizi veya baryum karbonatın (BaCO3) yüksek sıcaklıkta termal ayrışmasıyla da hazırlanabilir.
Genel olarak Ba(OH)2’nin sentezi, yüksek düzeyde yakıcı ve toksik özelliklerinden dolayı dikkatli kullanım ve uygun güvenlik önlemleri gerektirir. Tehlikeli maddelerle çalışırken uygun güvenlik protokollerine ve düzenlemelerine uymak önemlidir.
Baryum Hidroksit Kullanım Alanları
Ba(OH)2, yüksek reaktif doğası ve alkalin özellikleri nedeniyle çeşitli endüstriyel ve laboratuvar kullanımlarına sahiptir. Ana kullanımlarından biri, yağlayıcılar, plastikler ve pestisitler dahil olmak üzere çeşitli kimyasalların üretiminde kimyasal reaktif olarak kullanılmasıdır.
Ba(OH)2 ayrıca PVC ve diğer plastiklerde ısı ve UV ışınlarına maruz kalmanın neden olduğu renk bozulmasını ve bozulmayı önlemek için stabilizatör olarak kullanılır. Ayrıca optik cam ve yüksek kırılma indeksli cam gibi belirli cam türlerinin üretiminde de kullanılır.
Laboratuvarda Ba(OH)2, esterifikasyon ve transesterifikasyon reaksiyonları gibi çeşitli organik reaksiyonlarda katalizör olarak kullanılır. Ayrıca analitik kimyada zayıf asitlerin belirlenmesinde ve standart çözeltilerin hazırlanmasında titrant olarak kullanılır.
Ba(OH)2’nin başka bir uygulaması da, televizyonlar ve bilgisayar monitörleri için katot ışın tüplerinin üretiminde kullanılan baryum oksitin üretimidir.
Ba(OH)2 aynı zamanda endüstriyel atık suyun arıtılmasında, yabancı maddeleri uzaklaştırmak ve asidik veya alkali atık suları çevreye deşarj edilmeden önce nötralize etmek için de kullanılır.
Genel olarak Ba(OH)2, birçok endüstride ve laboratuvarda önemli bir rol oynar ve birçok ürünün ve prosesin üretimine katkıda bulunur.
Sorular:
Baryum hidroksit çözünür mü?
Evet, baryum hidroksit suda çözünür. Suda çözündüğünde pH’ı yaklaşık 12,5 olan alkali bir çözelti oluşturur. Ba(OH)2’nin sudaki çözünürlüğü nispeten yüksektir; çözünürlüğü oda sıcaklığında (25 °C) yaklaşık 3,52 g/100 mL’dir. Ba(OH)2’nin çözünürlüğü sıcaklık, basınç ve çözeltideki diğer maddelerin varlığı gibi faktörlerden etkilenebilir.
Baryum hidroksit güçlü bir baz mıdır?
Evet, baryum hidroksit güçlü bir bazdır. Suda çözündüğünde tamamen çözünerek çözeltide baryum iyonları (Ba2+) ve hidroksit iyonları (OH-) oluşur. Bu ayrışma, pH’ı yaklaşık 12,5 olan oldukça alkali bir çözelti üretir. Ba(OH)2’nin güçlü temel özellikleri, onu asidik atıkların etkili bir nötrleştiricisi ve çeşitli organik reaksiyonlarda bir katalizör haline getirir.
Baryum hidroksitin formülü nedir?
Baryum hidroksitin formülü Ba(OH)2’dir. Bu formül, her baryum hidroksit molekülünün bir baryum iyonu (Ba2+) ve iki hidroksit iyonu (OH-) içerdiğini gösterir. Baryum iyonu +2 yüke sahipken, hidroksit iyonu -1 yüke sahiptir. Ba(OH)2’deki iki hidroksit iyonu, nötr bir bileşik oluşturmak için baryum iyonunun +2 yükünü dengeler. Ba(OH)2 formülü, özelliklerini ve reaksiyonlarını anlamak, ayrıca molar kütlesini ve diğer fizikokimyasal özelliklerini hesaplamak için önemlidir.
