Baryum klorür dihidrat, BaCl2·2H2O kimyasal formülüne sahip beyaz kristalli bir bileşiktir. Laboratuvarlarda reaktif olarak ve endüstride metal yüzeylerin işlenmesinde yaygın olarak kullanılır.
| IUPAC Adı | Baryum klorür dihidrat |
| Moleküler formül | BaCl2·2H2O |
| CAS numarası | 10326-27-9 |
| Eş anlamlı | Baryum diklorür dihidrat; Baryum(II) klorür dihidrat; Hidratlı baryum klorür (1:2:2); Baryum klorür 2-hidrat; Baryum klorür dihidrat; Baryum diklorür, dihidrat; Baryum(2+) klorür dihidrat |
| InChI | InChI=1S/Ba.2ClH.2H2O/h;21H;21H2/q+2;;;/p-2 |
BaCl2·2H2O molar kütlesi
Baryum klorür dihidratın (BaCl2·2H2O) molar kütlesi 244,26 g/mol’dür. Bu değer, bileşikte bulunan her bir elementin atomik kütleleri toplanarak hesaplanabilir. Baryumun molar kütlesi 137,33 g/mol, klorun molar kütlesi 35,45 g/mol ve hidrojen ve oksijenin molar kütlesi sırasıyla 1,01 g/mol ve 16,00 g/mol’dür. İki su molekülü başka bir 36,02 g/mol ekler. BaCl2·2H2O’nun molar kütlesi, reaktan veya ürün miktarının mol cinsinden ifade edildiği stokiyometrik hesaplamalarda önemlidir.
Baryum Klorür Dihidrat Formülü
Baryum klorür dihidratın kimyasal formülü BaCl2·2H2O’dur. Bu formül, bileşiğin her formül biriminin bir baryum iyonu, iki klorür iyonu ve iki su molekülü içerdiğini gösterir. Formül, stokiyometrik hesaplamalar ve bileşiğin kimyasal ve fiziksel özelliklerinin anlaşılması için önemlidir.
Baryum klorür dihidratın kaynama noktası
BaCl2·2H2O’nun kaynama noktası 1560°C’dir. Bu sıcaklıkta bileşik, sıvıdan gaza faz geçişine uğrayacaktır. Yüksek kaynama noktası, iyonları bir arada tutan güçlü elektrostatik kuvvetleri parçalamak için büyük miktarda enerji gerektiren bileşiğin iyonik yapısından kaynaklanmaktadır. BaCl2 2H2O, yüksek erime ve kaynama noktaları nedeniyle endüstride metal yüzeyler için ısıl işlem maddesi olarak kullanılır.
Baryum klorür dihidratın erime noktası
BaCl2 · 2H2O’nun erime noktası 962 °C’dir. Bu sıcaklıkta bileşik katı halden sıvı hale geçecektir. BaCl2·2H2O’nun yüksek erime noktası, baryum ve klor iyonları arasındaki güçlü iyonik bağların yanı sıra su molekülleri arasındaki hidrojen bağlarından kaynaklanmaktadır. BaCl2·2H2O’nun erime noktası, pigment ve boya üretimi ve metal yüzeylerin işlenmesi gibi çeşitli uygulamalarda kullanılması açısından önemli bir özelliktir.
Baryum klorür dihidratın yoğunluğu g/ml
Baryum klorür dihidratın yoğunluğu 3.097 g/cm³’tür. Bu, 1 cm³ baryum klorür dihidratın 3.097 gram ağırlığında olduğu anlamına gelir. Bir maddenin yoğunluğu, onun fiziksel ve kimyasal özellikleri hakkında fikir verebilecek önemli bir özelliktir. Baryum klorür dihidrat durumunda, yüksek yoğunluk, baryumun nispeten büyük atom kütlesinden ve iyonların kristal kafes yapısındaki sıkı paketlenmesinden kaynaklanmaktadır.
BaCl2 · 2H2O molekül ağırlığı
BaCl2·2H2O’nun moleküler ağırlığı 244,26 g/mol’dür. Bu değer, bileşikte bulunan her bir elementin atom ağırlıkları toplanarak hesaplanabilir. Molekül ağırlığı BaCl2 · 2H2O’nun önemli bir özelliğidir çünkü pigment ve boya üretimi gibi çeşitli uygulamalarda ve laboratuvar deneylerinde reaktif olarak kullanılır.
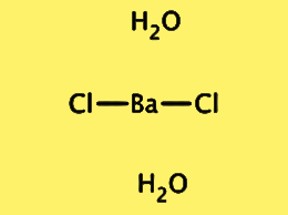
Yapı BaCl2·2H2O
BaCl2·2H2O’nun kristal yapısı Pnma uzay grubuna sahip ortorombiktir. Birim hücre, bir baryum iyonu, iki klorür iyonu ve iki su molekülünden oluşan BaCl2·2H2O formülüne sahip bir birim içerir. Baryum iyonu sekiz klorür iyonu ile çevrelenmiştir ve su molekülleri klorür iyonlarına hidrojen bağlanmıştır. BaCl2 · 2H2O’nun kristal yapısı, fiziksel ve kimyasal özelliklerinin yanı sıra çeşitli uygulamalardaki kullanımının anlaşılması açısından önemlidir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 3.097 g/cm³ |
| Renk | Renksizden beyaza |
| Koku | Kokusuz |
| Molar kütle | 244,26 gr/mol |
| Yoğunluk | 3.097 g/cm³ |
| Füzyon noktası | 962°C |
| Kaynama noktası | 1560°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | 31,2 g/100 mL (20°C’de) |
| çözünürlük | Alkol ve asetonda çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Nötr (7) |
Not: Kullandığınız platformun veya cihazın ekran ayarlarına bağlı olarak tablo doğru şekilde hizalanmayabilir.
Baryum klorür dihidratın güvenliği ve tehlikeleri
BaCl2 2H2O, uygun şekilde kullanılmadığı takdirde zararlı olabilecek çeşitli güvenlik ve sağlık tehlikeleri oluşturur. Temas halinde ciltte ve gözlerde ciddi yanıklara neden olabilecek aşındırıcı bir maddedir. Tozunun veya buharının solunması solunum problemlerine ve akciğer hasarına neden olabilir. Ayrıca yutulması halinde toksiktir ve gastrointestinal sorunlara neden olabilir. BaCl2 2H2O dikkatli kullanılmalı ve bileşikle çalışırken eldiven, gözlük ve solunum cihazı gibi uygun koruyucu ekipmanlar giyilmelidir. Kazara maruz kalmayı önlemek için uyumsuz maddelerden uzakta ve güvenli bir alanda saklanmalıdır. Acil bir durumda derhal tıbbi yardıma başvurun.
| Tehlike sembolleri | Aşındırıcı (C) | |
| Güvenlik Açıklaması | ||
| BİR tanımlayıcılar | UN1564 | |
| HS kodu | 28273990 | |
| Tehlike sınıfı | 8 | |
| Paketleme grubu | III | |
| Toksisite | Yutulması halinde toksiktir; mide-bağırsak sorunlarına neden olabilir. Cilt ve gözler için aşındırıcıdır. Toz veya buharın solunması solunum problemlerine ve akciğer hasarına neden olabilir. | |
Baryum klorür dihidratın sentezi için yöntemler
BaCl2 2H2O’yu çeşitli yöntemlerle sentezleyebilirsiniz.
Yaygın bir yöntem, baryum karbonatın veya baryum hidroksitin hidroklorik asitle reaksiyona sokulmasıdır. Katı bileşiği elde etmek için elde edilen çözeltiyi buharlaştırmanız gerekir.
Diğer bir yöntem ise baryum sülfürün hidroklorik asitle reaksiyona sokulmasıdır. Bu reaksiyon, uygun şekilde imha etmeniz gereken hidrojen sülfür gazı üretir. Elde edilen çözelti daha sonra süzülerek ve kristalleştirilerek saflaştırılarak nihai ürün elde edilir.
BaCl2 2H2O’yu ayrıca sodyum klorür ve baryum nitrat kullanarak bir çökeltme reaksiyonuyla da sentezleyebilirsiniz. İki bileşiği bir çözelti içinde karıştırmanız, ardından katı bileşiği elde etmek için elde edilen çökeltiyi filtreleyip kurutmanız gerekir.
Ayrıca baryum oksidin hidroklorik asitle reaksiyonundan BaCl2 · 2H2O sentezlenebilir. Bu reaksiyon, buharlaştırma yoluyla uzaklaştırmanız gereken bir yan ürün olarak su üretir. Elde edilen çözelti daha sonra nihai ürünü elde etmek üzere kristalleştirilir.
BaCl2 2H2O ile çalışırken aşındırıcı ve toksik bir bileşik olduğundan uygun güvenlik önlemlerini almalısınız. Eldiven, gözlük ve solunum cihazı gibi koruyucu ekipmanlar giymeli ve bileşiği iyi havalandırılan bir alanda kullanmalısınız.
Baryum klorür dihidratın kullanım alanları
BaCl2 2H2O’nun çeşitli endüstrilerde çeşitli kullanımları vardır.
- Kimya endüstrisi, baryum tuzları, pigmentler ve seramik üretimi gibi çeşitli kimyasal reaksiyonlarda reaktif olarak BaCl2 · 2H2O’yu kullanır.
- Metal rafinasyonunda bir akış maddesi ve organik sentezde bir katalizör olarak işlev görür.
- Tıp endüstrisi BaCl2 2H2O’yu radyografide kontrast madde olarak ve baryum zehirlenmesini tedavi etmek için kullanır. Ayrıca diş çimentolarının üretiminde de kullanılır.
- Tekstil endüstrisi, boyaları elyaflara bağlayan bir madde olan mordan olarak ve tekstiller için alev geciktirici olarak BaCl2 2H2O’yu kullanır.
- Petrol endüstrisinde BaCl2 2H2O, çamur yoğunluğunu arttırmak ve sondaj işlemleri sırasında patlamaları önlemek için sondaj çamuruna katkı maddesi olarak kullanılır.
- Gıda endüstrisi, belirli gıdalar için koruyucu ve lezzet arttırıcı olarak BaCl2 2H2O’yu kullanır.
Aşındırıcı ve toksik BaCl2 2H2O ile çalışmanın getirdiği riskleri en aza indirmek için koruyucu ekipman giymek ve bileşiği iyi havalandırılan bir alanda kullanmak gibi uygun güvenlik önlemleri alınmalıdır.
Sorular:
Baryum klorür dihidratın formülü nedir?
Baryum klorür dihidratın formülü BaCl2·2H2O’dur.
Baryum klorür dihidrat suda çözünür mü?
Evet, baryum klorür dihidrat suda oldukça çözünür. Oda sıcaklığında yaklaşık 31,2 g/100 mL çözünürlüğü ile suda kolaylıkla çözünür. Bu yüksek çözünürlük, onu baryum tuzlarının üretimi ve petrol endüstrisinde sondaj çamuru katkı maddesi gibi çeşitli endüstrilerde yararlı bir bileşik haline getirir. Ancak yüksek çözünürlüğü aynı zamanda su kaynaklarını kirletebileceği ve suda yaşayan organizmalar üzerinde toksisiteye neden olabileceği için doğru şekilde kullanılmadığı takdirde insan sağlığı ve çevre için risk oluşturabileceği anlamına da gelir. Bu nedenle BaCl2 2H2O ile çalışırken kontaminasyonu önlemek ve güvenli kullanımı sağlamak için uygun önlemler alınmalıdır.
