Hidrazin veya N2H4, nitrojen ve hidrojenden oluşan renksiz, oldukça reaktif bir bileşiktir. İlaçlarda ve tarım kimyasallarında roket itici olarak ve kimyasal reaksiyonlarda indirgeyici madde olarak kullanılır.
| IUPAC Adı | Hidrazin |
| Moleküler formül | N2H4 |
| CAS numarası | 302-01-2 |
| Eş anlamlı | Diamin; Diazane; Azot hidrit; Susuz hidrazin; Susuz hidrazin; Hidrazinyum hidroksit; Hidrazin hidratlı; Metilhidrazin; Simetrik hidrazin |
| InChI | InChI=1S/H4N2/c1-2/h2H,1H2 |
Lewis yapısı N2H4:
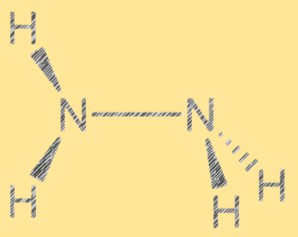
Hidrazinin Lewis yapısı moleküldeki elektronların dizilişini gösterir. Yapı, her biri bir çift serbest elektrona sahip iki nitrojen atomu ve dört hidrojen atomundan oluşur. İki nitrojen atomu tek bir kovalent bağla birleştirilir ve her nitrojen atomu da iki hidrojen atomuna bağlanır. Hidrazinin Lewis yapısı onun reaktivitesini ve özelliklerini açıklamaya yardımcı olur.
Bileşik N2H4’ün adı:
N2H4 bileşiğinin adı hidrazindir. Adı, hidrazinin hidrojen ve nitrojen atomları içeren bir bileşik olmasından kaynaklanmaktadır. Hidrazin ayrıca diamin, diazane ve nitrojen hidrit dahil olmak üzere çeşitli diğer isimlerle de bilinir.
Molar kütle N2H4:
N2H4 moleküler formülüne sahip hidrazinin molar kütlesi 32,04 g/mol’dür. İki nitrojen atomu ve dört hidrojen atomundan oluşan nispeten hafif bir bileşiktir. Hidrazin’in düşük molar kütlesi, yüksek bir itme-ağırlık oranı sağladığından, genellikle roket yakıtı olarak kullanılmasının nedenlerinden biridir.
Hidrazinin kaynama noktası:
Hidrazin, atmosferik basınçta 113,5 °C (236,3 °F) kaynama noktasına sahiptir. Bu düşük kaynama noktası, hidrazinin kolayca buharlaşabileceği anlamına gelir ve bu da onu tehlikeli hale getirebilir. Hidrazin ısıtıldığında nitrojen gazına ve hidrojen gazına ayrışabilir ve bu da onu tehlikeli hale getirebilir.
Hidrazinin erime noktası:
Hidrazinin erime noktası -51,7 °C’dir (-61,06 °F). Bu, hidrazinin oda sıcaklığında ve basınçta sıvı olduğu anlamına gelir. Düşük erime noktası aynı zamanda daha düşük sıcaklıklarda kolayca katılaşabileceği anlamına gelir ve bu da işlenmesini zorlaştırabilir.
Hidrazin yoğunluğu g/ml:
Hidrazin yoğunluğu oda sıcaklığında ve basınçta 1,00 g/mL’dir. Bu, hidrazinin, aynı koşullar altında yoğunluğu 1,00 g/mL olan sudan biraz daha yoğun olduğu anlamına gelir.
Hidrazinin moleküler ağırlığı:
Hidrazinin moleküler ağırlığı 32.04 g/mol’dür. Bu değer, kimyasal reaksiyonlarda ve diğer uygulamalarda ihtiyaç duyulan hidrazin miktarını hesaplamak için kullanılır.
Hidrazinin yapısı:
Hidrazinin yapısı, tek bir kovalent bağ ile birbirine bağlanan iki nitrojen atomundan oluşur ve her nitrojen atomu, aynı zamanda iki hidrojen atomuna da bağlıdır. Bu, hidrazine simetrik V şeklinde bir moleküler yapı kazandırır. Hidrazinin yapısı, reaktivitesinde ve özelliklerinde önemli bir rol oynar.
Hidrazin Formülü:
Hidrazinin kimyasal formülü N2H4’tür. Bu formül hidrazinin iki nitrojen atomu ve dört hidrojen atomundan oluştuğunu gösterir. Formül, kimyasal denklemlerde ve reaksiyonlarda hidrazini temsil etmek için kullanılır.
| Dış görünüş | Renksiz ila soluk sarı sıvı |
| Spesifik yer çekimi | 1,00 gr/ml |
| Renk | Renksiz |
| Koku | Amonyak kokusu |
| Molar kütle | 32,04 g/mol |
| Yoğunluk | 1,00 gr/ml |
| Füzyon noktası | -51,7°C (-61,06°F) |
| Kaynama noktası | 113,5°C (236,3°F) |
| Flaş noktası | 38°C (100°F) |
| sudaki çözünürlük | karışabilir |
| çözünürlük | Etanol, dietil eter, kloroformda çözünür |
| Buhar basıncı | 20°C’de 72 mmHg |
| Buhar yoğunluğu | 1,0 (hava=1) |
| pKa | 8 |
| pH | Temel (pH > 7) |
Hidrazin Güvenliği ve Tehlikeleri
Hidrazin, dikkatli kullanım ve depolama gerektiren oldukça reaktif ve tehlikeli bir bileşiktir. Toksiktir ve cilt, göz veya mukoza ile teması halinde ciddi yanıklara neden olabilir. Hidrazin buharlarının solunması ayrıca solunum yolu tahrişine, akciğer hasarına neden olabilir ve aşırı durumlarda ölümcül olabilir. Hidrazin ayrıca yanıcıdır ve özellikle oksitleyici maddeler gibi belirli malzemelerle temas ettiğinde kolayca tutuşabilir. Bu tehlikeler nedeniyle, hidrazinin taşınması sırasında uygun güvenlik önlemleri alınmalı ve kişisel koruyucu ekipman kullanılmalı ve yalnızca iyi havalandırılan alanlarda, uygun güvenlik eğitimi almış kalifiye profesyoneller tarafından kullanılmalıdır.
| Tehlike sembolleri | Kafatası ve kemiklerin, alev |
| Güvenlik Açıklaması | Yalnızca iyi havalandırılmış alanlarda kullanın. Eldiven, kıyafet ve göz/yüz koruması kullanın. Cilt, göz ve giysilerle temasından kaçının. Isıdan, kıvılcımdan ve alevden uzak tutun. |
| BM kimlik numaraları | BM 2030 |
| HS kodu | 282510 |
| Tehlike sınıfı | 6.1 (Zehirli maddeler) |
| Paketleme grubu | II |
| Toksisite | Yutulması, solunması ve ciltle teması halinde çok toksiktir. Ciddi yanıklara ve doku hasarına neden olabilir. Uzun süreli maruz kalma karaciğer ve böbrek hasarına neden olabilir ve potansiyel olarak kanserojen olabilir. |
Hidrazin Sentez Yöntemleri
Hidrazin, istenen saflığa ve spesifik uygulamaya bağlı olarak çeşitli yöntemlerle sentezlenebilir. Hidrazin sentezlemenin bazı yaygın yöntemleri şunlardır:
- Raschig Prosesi: Bu yöntem, amonyak ve sodyum hipokloritin bakır veya nikel gibi bir katalizör varlığında reaksiyonunu içerir.
- Olin-Raschig Süreci: Bu süreç, hidrazin hidrat üretmek için üre ve hidroklorik asidin reaksiyonunu içerir.
- Ketazin işlemi: Bu işlem, Raney nikeli gibi bir katalizör varlığında asetonun amonyakla reaksiyonunu içerir.
- Peroksit işlemi: Bu işlem, platin veya paladyum gibi bir katalizör varlığında hidrojen peroksit ve amonyağın reaksiyonunu içerir.
- Bayer işlemi: Bu işlem, bakır veya nikel gibi bir katalizör varlığında sodyum hipokloritin üre ile reaksiyonunu içerir.
- Houben-Hoesch reaksiyonu: Bu reaksiyon, nitröz asidin çinko gibi bir indirgeyici ajanın varlığında amonyakla reaksiyonunu içerir.
Her yöntemin kendine göre avantajları ve dezavantajları vardır ve yöntemin seçimi maliyet, verim, saflık ve güvenlik hususları gibi faktörlere bağlı olacaktır. Hidrazin tehlikeli bir madde olduğundan ve doğru şekilde kullanılmadığı takdirde insan sağlığı ve güvenliği açısından risk oluşturabileceğinden, hidrazin sentezi dikkatli bir şekilde gerçekleştirilmelidir.
Hidrazin Kullanım Alanları
N2H4, benzersiz kimyasal özellikleri nedeniyle çok çeşitli endüstriyel, ticari ve askeri uygulamalara sahiptir. N2H4’ün bazı yaygın kullanımları şunlardır:
- Şirketler, yüksek enerji içeriği ve kararlılığı nedeniyle N2H4’ü roket yakıtı olarak kullanıyor.
- N2H4, aralarında naylon ve Kevlar’ın da bulunduğu bazı polimerlerin üretiminde polimerizasyon maddesi olarak kullanılır.
- Kimyacılar N2H4’ü kimyasal sentez reaksiyonlarında, özellikle farmasötiklerin, pestisitlerin ve diğer organik bileşiklerin üretiminde indirgeyici madde olarak kullanırlar.
- N2H4, metal kaplama işlemlerinde, özellikle nikel kaplamada indirgeyici madde olarak işlev görür.
- Su arıtma tesisleri, özellikle kazanlarda ve soğutma kulelerinde N2H4’ü oksijen tutucu olarak kullanır.
- Fotoğrafçılar, özellikle siyah beyaz fotoğrafçılıkta N2H4’ü fotoğraf geliştirici olarak kullanıyor.
- Araba üreticileri, otomobil hava yastığı sistemlerinde şişirici olarak N2H4’e güveniyor.
- Endüstriler, özellikle elektronik endüstrisinde, belirli ekipman ve yüzeyler için temizlik maddesi olarak N2H4’ü kullanır.
Hidrazin birçok yararlı uygulamaya sahip olmasına rağmen aynı zamanda tehlikeli bir maddedir ve dikkatle kullanılmalıdır. Hidrazin kullanılırken uygun güvenlik önlemleri ve kişisel koruyucu ekipmanlar kullanılmalı ve bunlar yalnızca uygun güvenlik eğitimi almış kalifiye profesyoneller tarafından kullanılmalıdır.
Sorular:
N2H4’teki N’nin oksidasyon numarası (oksidasyon durumu) nedir?
N2H4’te N’nin oksidasyon sayısı (oksidasyon durumu) -2’dir. Her hidrojen atomunun oksidasyon numarası +1’dir ve N2H4 nötr bir molekül olduğundan tüm atomların oksidasyon numaralarının toplamı sıfıra eşit olmalıdır. N2H4’te iki nitrojen atomu bulunduğundan moleküldeki nitrojenin toplam oksidasyon sayısı -4’tür. Bu nedenle her nitrojen atomunun oksidasyon sayısı -2’dir ve bu da hidrojen atomlarının oksidasyon sayılarını dengeler.
N2H4 bileşiğinin adı nedir?
N2H4 bileşiğine genel olarak hidrazin denir.
Hidrazinin (n2h4) hidrojen peroksite (h2o2) ve hidrazinin suya molar oranları nelerdir?
Hidrazinin (N2H4) hidrojen peroksite (H2O2) ve hidrazinin suya molar oranları, ilgili reaksiyonların dengeli kimyasal denklemlerinden belirlenebilir.
Hidrazin hidrojen peroksit ile reaksiyona girdiğinde aşağıdaki dengeli denkleme göre nitrojen gazı (N2), su (H2O) ve oksijen gazı (O2) üretir:
N2H4 + H2O2 → N2 + 2H2O + O2
Bu denkleme göre hidrazinin hidrojen peroksite molar oranı 1:1’dir. Bu, reaksiyonda kullanılan her bir mol hidrazine karşılık bir mol hidrojen peroksitin tüketildiği anlamına gelir.
Hidrazin suyla reaksiyona girdiğinde N2H4·H2O kimyasal formülüne sahip hidrazin hidratı oluşturur. Bu reaksiyonun dengeli kimyasal denklemi şöyledir:
N2H4 + H2O → N2H4·H2O
Bu denkleme göre hidrazin/su molar oranı 1:1’dir. Bu, reaksiyonda kullanılan her bir mol hidrazin için bir mol su tüketildiği ve bir mol hidrazin hidratın üretildiği anlamına gelir.
