Etanol veya C2H6O, bitki materyallerinden elde edilen ve sıklıkla biyoyakıt veya solvent olarak kullanılan renksiz, yanıcı bir alkoldür. Aynı zamanda alkollü içeceklerde de yaygın olarak kullanılan bir maddedir.
| IUPAC Adı | Etanol |
| Moleküler formül | C2H6O |
| CAS numarası | 64-17-5 |
| Eş anlamlı | Etil alkol, tahıl alkolü, EtOH, alkol |
| InChI | InChI=1S/C2H6O/c1-2-3/h3H,2H2,1H3 |
Etanolun özellikleri
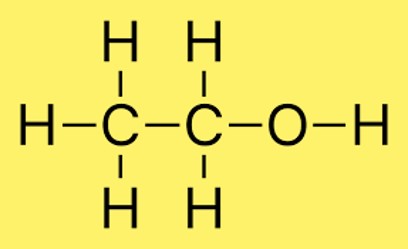
Lewis yapısı C2H6O
C2H6O (etanol olarak da bilinir) için Lewis yapısı aşağıdaki gibi çizilebilir:
HH
| |
HCCOH
| |
HH
Bu yapıda iki karbon atomu birbirine tek bir kovalent bağla bağlanır. Her karbon atomu ayrıca üç hidrojen atomuna ve bir karbon atomu bir oksijen atomuna bağlanır. Oksijen atomu karbon atomuna tek bir kovalent bağ ile bağlıdır ve iki çift serbest elektrona sahiptir.
Bu yapı, moleküldeki her atomun değerlik kabuğunda sekiz elektrona sahip olması gerektiğini belirten oktet kuralını karşılar. Karbon atomlarının değerlik kabuklarında dört elektron bulunurken, hidrojen atomlarının her birinde birer elektron bulunur. Oksijen atomunun altı değerlik elektronu vardır ve iki ek yalnız çiftle birlikte oktet kuralını karşılar.
C2H6O Molar Kütle
Etanolün molar kütlesi yaklaşık 46,07 g/mol’dür. Bir maddenin molar kütlesi, o maddenin bir molünün kütlesi olarak tanımlanır. Etanol durumunda, bir mol etanol yaklaşık 46.07 gram madde içerir. Molar kütle, kimyasal hesaplamalarda yararlı bir parametredir çünkü bir maddenin kütlesi ile molleri arasında dönüşüme izin verir.
Etanolün kaynama noktası
Etanolün kaynama noktası standart basınçta yaklaşık 78,5°C’dir (173,3°F). Bu nispeten düşük kaynama noktası, birçok endüstriyel proseste faydalı olan etanolün buharlaşmasını kolaylaştırır. Örneğin etanol, farmasötiklerin, parfümlerin ve diğer kimyasalların üretiminde çözücü olarak yaygın olarak kullanılır.
Etanolün Erime Noktası
Etanolün erime noktası yaklaşık -114,1°C’dir (-173,4°F). Bu düşük erime noktası, etanolü oda sıcaklığında sıvı hale getirir, bu nedenle genellikle sıvı formda çözücü veya yakıt olarak kullanılır. Etanolün erime noktası suyunkinden daha düşüktür, bu da etanolün otomobil soğutma sistemlerinde antifriz olarak kullanılmasına olanak tanır.
Etanol yoğunluğu g/mL
Etanolün yoğunluğu standart sıcaklık ve basınçta yaklaşık 0,789 g/mL’dir. Bu, bir mililitre etanolün 0,789 gram ağırlığında olduğu anlamına gelir. Etanolün yoğunluğu, standart sıcaklık ve basınçta yoğunluğu 1 g/mL olan suyunkinden daha düşüktür. Bu, etanolün suyun yüzeyinde yüzeceği anlamına gelir.
Etanol Molekül Ağırlığı
Etanolün moleküler ağırlığı yaklaşık 46,07 g/mol’dür. Molekül ağırlığı, bir moleküldeki tüm atomların atom ağırlıklarının toplamıdır. Etanolde iki karbon atomu, altı hidrojen atomu ve bir oksijen atomu bulunur. Molekül ağırlığı, bir maddenin belirli bir kütlesindeki mol sayısını hesaplamak için kullanılır.
Etanolün yapısı
Etanolün yapısında iki karbon atomu tek bir bağla bağlanır ve her karbon atomuna üç hidrojen atomu bağlanır. Ek olarak oksijen atomuna bir hidrojen atomu bağlanır. Moleküldeki atomların düzeni genellikle CH3CH2OH ile temsil edilir.
Etanol formülü
Etanolün kimyasal formülü C2H6O’dur. Bu formül moleküldeki atomların sayısını ve türünü gösterir. Formül, etanolün moleküler ağırlığının yanı sıra belirli bir madde kütlesindeki etanolün mol sayısını hesaplamak için kullanılabilir. Formül aynı zamanda etanolün diğer kimyasallarla reaksiyonlardaki kimyasal davranışını tahmin etmek için de faydalıdır.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 0,789 |
| Renk | Renksiz |
| Koku | Karakteristik koku |
| Molar kütle | 46,07 gr/mol |
| Yoğunluk | 0,789 gr/ml |
| Füzyon noktası | -114,1°C (-173,4°F) |
| Kaynama noktası | Standart basınçta 78,5°C (173,3°F) |
| Flaş noktası | 13°C (55°F) |
| sudaki çözünürlük | karışabilir |
| çözünürlük | Polar ve polar olmayan solventlerde çözünür |
| Buhar basıncı | 20°C’de 44,6 kPa |
| Buhar yoğunluğu | 1,59 (hava = 1) |
| pKa | 15,9 ila 25°C |
| pH | 7 (nötr) |
Etanol güvenliği ve tehlikeleri
Etanol yanıcı bir sıvıdır ve uygun şekilde kullanılmazsa yangın ve patlama tehlikesi yaratabilir. Etanol buharları da kolaylıkla tutuşabilir ve ciddi bir yangın tehlikesi oluşturabilir. Etanol yutulması halinde de zararlı olabilir ve aşırı tüketimi alkol zehirlenmesine yol açabilir. Büyük miktarda etanol buharının solunması baş dönmesine, baş ağrısına ve mide bulantısına neden olabilir. Etanole uzun süre maruz kalmak da ciltte tahrişe ve kurumaya neden olabilir. Etanol, tutuşma kaynaklarından ve uyumsuz maddelerden uzakta, serin ve iyi havalandırılan bir alanda saklanmalıdır. Etanolle çalışırken eldiven ve koruyucu gözlük gibi uygun koruyucu ekipmanlar kullanılmalıdır.
| Tehlike sembolleri | F, Xi, Flam. Sıvı. 2 |
| Güvenlik Açıklaması | Isıdan, kıvılcımdan, açık alevden ve sıcak yüzeylerden uzak tutun. Sigara İçmek Yasaktır. Patlamaya dayanıklı elektrik, havalandırma ve aydınlatma ekipmanı kullanın. Buharları solumaktan kaçının. Koruyucu eldiven, koruyucu gözlük kullanın. Yangın durumunda: Söndürmek için kuru kimyevi toz, CO2, su spreyi veya köpük kullanın. İçeriği/kabı yerel/bölgesel/ulusal/uluslararası düzenlemelere uygun olarak atın. |
| BİR tanımlayıcılar | UN1170 |
| HS kodu | 2207.10.00 |
| Tehlike sınıfı | 3 |
| Paketleme grubu | II |
| Toksisite | Etanol büyük miktarlarda yutulduğunda veya solunduğunda toksik olabilir. Uzun süreli maruz kalma aynı zamanda cildin tahriş olmasına ve kurumasına neden olabilir. Kronik yutma alkolizme ve diğer sağlık sorunlarına yol açabilir. |
Etanol sentez yöntemleri
Etanol, fermantasyon, doğrudan etilen hidrasyonu ve biyokütle dönüşümü dahil olmak üzere çeşitli yöntemlerle sentezlenebilir.
Fermantasyon, etanol üretmenin en yaygın yöntemidir ve şekerlerin ve diğer karbonhidratların maya gibi mikroorganizmalar tarafından etanole dönüştürülmesini içerir. Bu işlem mısır, arpa ve şeker kamışı gibi mahsullerin yanı sıra gıda atıkları ve tarım artıkları gibi atık malzemelerden etanol üretmek için kullanılıyor.
Etilenin doğrudan hidrasyonu, etanol üretmenin başka bir yöntemidir. Bu işlemde etilen , etanol oluşturmak üzere fosforik asit gibi bir katalizör varlığında suyla reaksiyona girer. Bu yöntem endüstriyel ortamlarda yaygın olarak kullanılır ve fermantasyondan daha verimlidir.
Biyokütle dönüşümü, etanol üretmenin başka bir yöntemidir ve talaş, çimen ve tarım artıkları gibi bitki materyallerinin etanole dönüştürülmesini içerir. İşlem, bitki materyalindeki selüloz ve hemiselülozun, etanole fermente edilebilecek basit şekerlere parçalanmasını içerir.
Etanol üretmenin diğer yöntemleri arasında katalitik karbon dioksit dönüşümü ve elektrokimyasal karbondioksit azaltımı yer alır.
Bu yöntemlerin her birinin avantajları ve dezavantajları vardır ve yöntemin seçimi hammadde bulunabilirliği, maliyet ve etkinlik gibi faktörlere bağlıdır. Fermantasyon, maliyet etkinliği ve güvenilirliği nedeniyle etanol üretiminde en yaygın kullanılan yöntem olmayı sürdürüyor.
Etanol kullanımları
Etanolün çok çeşitli endüstriyel, ticari ve kişisel kullanımları vardır. Yaygın kullanımlarından bazıları şunlardır:
- Etanol, benzin katkı maddesi olarak kullanıldığında oktan seviyelerini artırır ve emisyonları azaltır.
- Etanol, farmasötik, kozmetik ve kişisel bakım ürünlerinin üretiminde yaygın olarak kullanılan çok yönlü bir solventtir.
- Bira, şarap ve alkollü içkiler gibi alkollü içecekler aktif madde olarak etanol içerir.
- El dezenfektanları, yüzey temizleyicileri ve diğer temizlik ürünleri, etkili bir dezenfektan olarak etanolü kullanır.
- Etanol, uçucu yağların, aromaların ve diğer doğal bileşiklerin ekstraksiyonunda çözücü olarak kullanılır.
- Üreticiler etanolü asetik asit ve etilen gibi diğer kimyasalların üretiminde hammadde olarak kullanıyor.
- Parfümler, losyonlar ve saç bakım ürünleri gibi kişisel bakım ürünlerinde koruyucu ve koku maddesi olarak etanol kullanılır.
- Kimya laboratuvarları genellikle solvent ve reaktif olarak etanol kullanır.
- Otomotiv ve diğer soğutma sistemleri, antifriz maddesi olarak etanol kullanabilir.
Sorular:
Bir etanol molekülü (C2H6O) kaç atomdan oluşur?
Bir etanol molekülü (C2H6O) 9 atomdan oluşur: 2 karbon atomu, 6 hidrojen atomu ve 1 oksijen atomu.
