Metil etil keton veya MEK olarak da bilinen 2 Butanon, tatlı, meyvemsi bir kokuya sahip, renksiz, yanıcı bir sıvıdır. Çeşitli endüstriyel ve ev uygulamalarında solvent olarak yaygın olarak kullanılır.
| IUPAC Adı | 2-bütanon |
| Moleküler formül | C4H8O |
| CAS numarası | 78-93-3 |
| Eş anlamlı | Metil etil keton (MEK), bütan-2-on, 2-butanon, 3-oksobutan-2-on |
| InChI | InChI=1S/C4H8O/c1-3-4-5-2/h3-4H,1-2H3 |
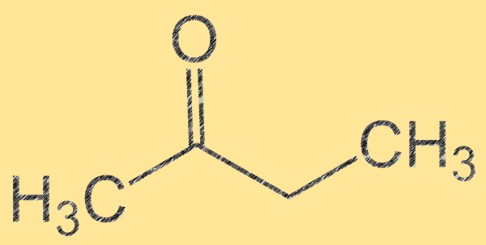
Bütanonun yapısı
Bütanonun moleküler formülü C4H8O’dur ve moleküler yapısı CH3C(O)CH2CH3 olarak temsil edilebilir. Tatlı, meyvemsi bir kokuya sahip, renksiz, yanıcı bir sıvıdır. Butanon bir ketondur, yani bir karbon atomuna bağlı bir karbonil grubu (C=O) içerir. Bu karbonil grubu, bütanonu çeşitli organik bileşiklerin sentezinde önemli bir ara madde haline getirir.
2-Butanon Molar Kütlesi
Metil etil keton (MEK) olarak da bilinen butanonun molar kütlesi 72,11 g/mol’dür. Bu, belirli bir bütanon numunesindeki, mol başına gram cinsinden ifade edilen madde miktarıdır. Molar kütle, kimyadaki çeşitli hesaplamalarda ve deneylerde kullanılan, bütanonun önemli bir özelliğidir; örneğin, belirli bir molar oranda başka bir maddeyle reaksiyona girmesi gereken bir maddenin kütlesini belirlemek için kullanılır. Bütanonun molar kütlesi, kütlesini mollere dönüştürmek için de kullanılabilir; bu, kimyasal reaksiyonlar, kimyasal sentez ve analitik kimya dahil olmak üzere birçok uygulamada faydalıdır.
MEK’in kaynama noktası
MEK’in kaynama noktası 80,6°C’dir (176,5°F). Bu, MEK’in sıvı halden gaz haline geçtiği sıcaklıktır. Kaynama noktası MEK’in önemli bir özelliğidir çünkü buharlaşma ve buhar oluşturma yeteneğini etkiler. Örneğin bazı uygulamalarda MEK bir çözücü olarak kullanılır ve çözünen maddenin uzaklaştırılabilmesi için hızlı bir şekilde buharlaşması arzu edilir. Diğer uygulamalarda MEK’in sıvı formda kalması arzu edilir, böylece kaynama noktasında veya bunun altında gerçekleştirilen reaksiyonlar için bir solvent olarak kullanılabilir.
MEK Erime noktası
MEK’in erime noktası -93,9°C’dir (-136,0°F). Bu, MEK’in katı halden sıvı duruma geçtiği sıcaklıktır. Erime noktası MEK’in önemli bir özelliğidir çünkü katı maddeler için çözücü olarak kullanılma yeteneğini etkiler. Örneğin MEK, katı yağlar, mumlar ve reçineler gibi erime noktası kendi erime noktasından daha düşük olan belirli katılar için bir çözücü olarak kullanılabilir.
MEK yoğunluğu g/mL
MEK’in yoğunluğu 0,80 g/mL’dir. Bu, MEK’in birim hacmi başına kütlesidir ve belirli bir hacim için gereken MEK miktarının hesaplanması da dahil olmak üzere birçok uygulamada kullanılan önemli bir özelliktir. MEK’in yoğunluğu aynı zamanda bir mol MEK’in kapladığı hacim olan molar hacmini hesaplamak için de kullanılır. Bu bilgi, bir maddenin molar kütlesinin belirlenmesi de dahil olmak üzere çeşitli deneylerde faydalıdır.
MEK Molekül Ağırlığı
MEK’in moleküler ağırlığı 72,11 g/mol’dür. Bir MEK molekülündeki atomların atom ağırlıklarının toplamıdır ve bir maddenin molar kütlesinin hesaplanması da dahil olmak üzere birçok uygulamada kullanılan önemli bir özelliktir. MEK’in moleküler ağırlığı, kütlesini mollere dönüştürmek için kullanılabilir; bu, kimyasal reaksiyonlar, kimyasal sentez ve analitik kimya dahil olmak üzere birçok uygulamada faydalıdır.
MEK formülü
MEK’in kimyasal formülü C4H8O’dur. Bu formül göreceli oranları temsil eder.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 0,79 – 0,80 |
| Renk | Renksiz |
| Koku | Tatlı, meyveli |
| Molar kütle | 72,11 g/mol |
| Yoğunluk | 0,79 – 0,80 g/mL |
| Füzyon noktası | -93,9°C (-136,0°F) |
| Kaynama noktası | 80,6°C (176,5°F) |
| Flaş noktası | 12°C (53,6°F) |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Çoğu organik çözücüde çözünür |
| Buhar basıncı | 38 mmHg (20°C) |
| Buhar yoğunluğu | 2,3 (hava = 1) |
| pKa | 20.2 |
| pH | 7 (nötr) |
Not: Bu tabloda verilen değerler yaklaşık değerler olup, kaynağa ve ölçüm koşullarına bağlı olarak biraz değişiklik gösterebilir.
Bütanonun güvenliği ve tehlikeleri
Metil etil keton olarak da bilinen butanon, uygun güvenlik önlemleriyle kullanılmadığı takdirde ciltte, gözlerde ve solunum yollarında tahrişe neden olabilecek yanıcı ve uçucu bir sıvıdır. Yüksek konsantrasyonda bütanonun solunması baş ağrısına, baş dönmesine, mide bulantısına ve bilinç kaybına neden olabilir. Düşük konsantrasyonlarda bütanona uzun süre maruz kalmak böbrek ve karaciğer hasarına neden olabilir. Aynı zamanda son derece yanıcıdır ve kolayca tutuşarak yangın tehlikesi oluşturabilir. Bütanon kullanırken iyi havalandırılmış bir alanda çalışmak, koruyucu kıyafet ve gözlük kullanmak ve cilt ile temasından kaçınmak önemlidir. Cilt veya gözlerle teması halinde derhal suyla yıkayın ve gerekirse doktora başvurun. Yutulması halinde kusturmaya çalışmayın ve derhal tıbbi yardıma başvurun. Butanon serin, kuru, iyi havalandırılan bir yerde, ısı kaynaklarından ve alevlerden uzakta saklanmalıdır.
| Tehlike sembolleri | Yanıcı sıvı, Tahriş edici |
| Güvenlik Açıklaması | S2 – Çocukların ulaşamayacağı yerde saklayın<br>S16 – Tutuşturucu kaynaklardan uzak tutun<br>S24/25 – Cilt ve gözlerle temasından kaçının<br>S26 – Gözle teması halinde derhal bol su ile yıkayın. ve tıbbi tavsiye alın |
| BİR tanımlayıcılar | UN1090 |
| HS kodu | 29141100 |
| Tehlike sınıfı | 3 (Yanıcı sıvı) |
| Paketleme grubu | II |
| Toksisite | LD50 (oral, sıçan) – 4.220 mg/kg |
Bütanon sentez yöntemleri
Butanon, 2-bütanolün doğrudan oksidasyonu ve aseton ve 2-propanolün aldol yoğunlaşması dahil olmak üzere çeşitli yöntemlerle sentezlenebilir.
Doğrudan oksidasyon yöntemi, 2-bütanolün kromik asit, hidrojen peroksit veya nitrik asit ve sülfürik asit karışımı gibi bir oksitleyici madde ile reaksiyonunu içerir. Reaksiyon asidik bir ortamda gerçekleşir ve elde edilen metil etil keton, damıtma yoluyla reaksiyon karışımından ayrılır.
Aldol yoğunlaştırma yöntemi, asetonun, sodyum hidroksit veya potasyum hidroksit gibi güçlü bir bazın varlığında 2-propanol ile reaksiyonunu içerir. Reaksiyon, damıtma yoluyla ayrılan bir metil etil keton ve diğer yan ürünler karışımı üretir.
Başka bir sentez yöntemi, asetonun formaldehit ile sülfürik asit veya p-tolüensülfonik asit gibi bir katalizör varlığında reaksiyonunu içerir. Bu reaksiyon, damıtma yoluyla ayrılan metil etil keton, formaldehit ve diğer yan ürünlerden oluşan bir karışım üretir.
Genel olarak, metil etil ketonun sentezi, minimum yan ürünle yüksek kaliteli bir ürünün üretilmesini sağlamak için reaksiyon koşullarının dikkatli bir şekilde kontrol edilmesini gerektirir. Metil etil ketonun sentezinde yer alan kimyasallar ve reaksiyonlarla çalışırken uygun güvenlik önlemlerinin takip edilmesi önemlidir.
Bütanonun Kullanım Alanları
Metil etil keton olarak da bilinen butanon, çözücülüğü, uçuculuğu ve düşük kaynama noktası nedeniyle geniş bir endüstriyel kullanım alanına sahiptir. Bütanonun en yaygın kullanımlarından bazıları şunlardır:
- Çözücü: Metil etil keton, reçineler, yapıştırıcılar, mürekkepler, boya sökücüler, baskı mürekkepleri, nitroselüloz laklar ve sentetik kauçuklar gibi çeşitli maddeler için çözücü olarak kullanılır.
- Temizlik maddesi: Elektronik endüstrisi, metal parçaları ve yüzeyleri gres, yağ ve diğer kirleticilerden temizlemek için temizlik maddesi olarak kullanır.
- İlaç: İlaç endüstrisinde, metil etil keton aşı, antibiyotik ve diğer ilaçların üretiminde çözücü olarak kullanılır.
- Kaplamalar: Ahşap, kağıt ve diğer malzemelere yönelik kaplamalar, üretimlerinde ve ayrıca vernik, cila ve diğer koruyucu kaplamaların üretiminde solvent olarak metil etil ketonu kullanır.
- Parfümler: Kozmetik ve gıda endüstrileri, parfümler ve tatlandırıcılar için çözücü olarak metil etil ketonu kullanır.
- Yapıştırıcılar: Yapıştırıcılar ve sızdırmazlık malzemeleri aynı zamanda üretimlerinde solvent olarak metil etil ketonu kullanır.
Metil etil ketonun endüstriyel kullanımlarının yanı sıra yakıt olarak potansiyeli de araştırılmaktadır. Diğer yakıtlarla karşılaştırıldığında yüksek enerji içeriği ve düşük toksisitesi onu umut verici bir alternatif enerji kaynağı haline getirmektedir.
Sorular:
Aşağıdaki reaksiyon ne verecek? 2-bütanon + h2/ni katalizörü
2-butanonun nikel katalizörü üzerinde hidrojen gazı ile reaksiyonu, hidrojenasyon reaksiyonu olarak bilinir. Bu reaksiyon aşağıdaki ürünü verecektir:
2-bütanon + H2 -> 2-bütanol
2-bütanonun keton grubundaki karbon ve oksijen atomları arasındaki çift bağın indirgenmesi, hidrojen gazının bir nikel katalizörü ile etkinleştirilmesiyle 2-bütanol oluşumuyla sonuçlanır. Kimya endüstrisi, diğer kimyasal üretim için değerli bir solvent ve hammadde olan 2-butanol üretmek için bu reaksiyonu yaygın olarak kullanır. 2-bütanonun 2-bütanole verimli ve seçici hidrojenasyonu için sıcaklık, basınç ve katalizör tipinin dikkatli kontrolü gereklidir.
2 bütanon bir keton mudur?
Organik kimya, metil etil keton olarak da bilinen 2-butanonu, bir hidrokarbon zinciri içindeki bir karbon atomuna bağlı bir karbonil grubuna (C=O) sahip bir keton türü olarak karakterize eder. 2-bütanon’un karbonil grubu iki karbon atomu arasında bulunur, dolayısıyla “metil etil keton” etiketi de buradan gelir.
2-butanonun kızılötesi spektrumu nedir?
2-butanonun (metil etil keton olarak da bilinir) IR (kızılötesi) spektrumu, moleküler yapısı ve fonksiyonel grupları hakkında önemli bilgiler sağlayabilir. 2-butanonun IR spektrumu genellikle aşağıdaki ana absorpsiyon bantlarını gösterir:
- Karbonil gerilmesi: Bu bant 1700 ile 1700 cm^-1 arasında keskin bir tepe noktası olarak görünür ve ketonun C=O fonksiyonel grubunun karakteristiğidir.
- Alkil gerilmesi: 2900 ile 3000 cm^-1 arasındaki zirveler, 2-bütanondaki CH2 ve CH3 gruplarının gerilme titreşimlerine karşılık gelir.
- CH bükülmesi: 1400 ile 1500 cm^-1 arasındaki tepe noktaları, 2-bütanondaki CH bağlarının bükülme titreşimlerine karşılık gelir.
- COC bükülmesi: 1300 ile 1400 cm^-1 arasındaki tepe noktası, 2-bütanondaki COC grubunun bükülme titreşimlerine karşılık gelir.
2-bütanonun IR spektrumunun, numune hazırlama ve kullanılan aletlerin yanı sıra yabancı maddelerin veya kirletici maddelerin varlığından etkileneceğini unutmamak önemlidir.
