Amonyum oksit ((NH4)2O), suda çözünebilen ve zayıf bir baz görevi gören beyaz kristalli bir bileşiktir. Amonyak ve oksijenin reaksiyonu sonucu üretilir ve gübrelerde, temizlik maddelerinde ve yangın söndürücü olarak kullanılır.
| IUPAC Adı | Amonyum oksit |
| Moleküler formül | (NH4)2O |
| CAS numarası | 12046-03-6 |
| Eş anlamlı | Amonyum hidroksit, amonyak çözeltisi, Aqua Amonyak |
| InChI | InChI=1S/H4N.O/h1H4;/q+1;-1 |
Amonyum oksitin özellikleri
Amonyum Oksit Formülü
Amonyum oksitin formülü (NH4)2O’dur. Bir nitrojen atomu ve dört hidrojen atomunun bir oksijen atomuyla birleşmesinden oluşan bir bileşiktir.
Amonyum Oksit Molar Kütlesi
Amonyum oksidin molar kütlesi mol başına yaklaşık 52.07 gramdır. Molekülde bulunan tüm atomların atom ağırlıkları toplanarak hesaplanır. Molar kütle, belirli bir madde miktarında bulunan parçacık sayısının belirlenmesine yardımcı olur.
Amonyum oksitin kaynama noktası
(NH4)2O’nun kaynama noktası yaklaşık 90°C’dir. Bir sıvının buhar basıncının etrafındaki basınca eşit olduğu ve sıvının gaza dönüşmesine neden olan sıcaklıktır. Bir maddenin kaynama noktası, farklı bileşikleri tanımlamak ve ayırt etmek için kullanılabilecek önemli bir fiziksel özelliktir.
Amonyum oksitin erime noktası
(NH4)2O’nun erime noktası yaklaşık -6°C’dir. Bu, katının sıvıya dönüştüğü sıcaklıktır. Bir maddenin erime noktası, farklı bileşiklerin tanımlanması ve ayırt edilmesinin yanı sıra bir maddenin saflığının belirlenmesi için de kullanılabilir.
Amonyum oksit yoğunluğu g/ml
(NH4)2O’nun yoğunluğu yaklaşık 1,02 g/ml’dir. Yoğunluk birim hacim başına kütle miktarıdır ve bir maddenin temel fiziksel özelliğidir. Bir maddenin yoğunluğu, farklı bileşiklerin tanımlanması ve ayırt edilmesinin yanı sıra bir maddenin saflığının belirlenmesi için de kullanılabilir.
Amonyum oksidin moleküler ağırlığı
Amonyum oksidin moleküler ağırlığı yaklaşık 52,07 g/mol’dür. Maddenin bir molekülünde bulunan tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, belirli bir kütlede bulunan bir maddenin mol sayısını hesaplamak için kullanılabilir ve bilimin birçok alanında kullanılan önemli bir fiziksel özelliktir.
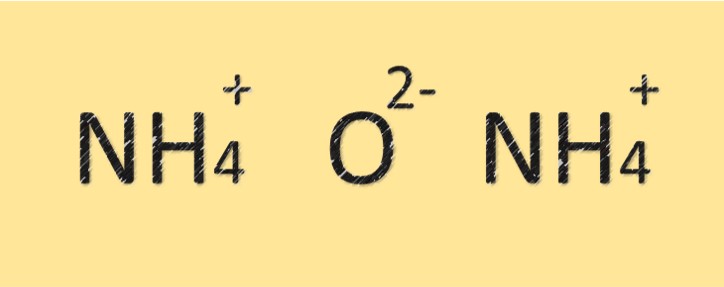
Amonyum oksitin yapısı
Amonyum oksit, nitrojen ve oksijen atomlarından oluşan bir bileşiktir. (NH4)2O moleküler formülüne sahiptir ve iki nitrojen atomu ve bir oksijen atomundan oluşur. Azot atomu oksijen atomuna kovalent bir bağla bağlıdır ve ayrıca pozitif bir yüke sahiptir. Bileşik, amonyum iyonunun varlığına bağlı olarak bazik veya alkalin bir karaktere sahiptir.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 1,02 g/cm³ |
| Renk | Beyaz |
| Koku | Amonyak |
| Molar kütle | 52,07 g/mol |
| Yoğunluk | 1,02 g/cm³ |
| Füzyon noktası | -6°C |
| Kaynama noktası | 90°C |
| Flaş noktası | Yok |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Suda çözünebilir |
| Buhar basıncı | Yok |
| Buhar yoğunluğu | Yok |
| pKa | Yok |
| pH | 11,6 (100 g/L, H2O, 20°C) |
Amonyum oksitin güvenliği ve tehlikeleri
(NH4)2O gözleri, cildi ve solunum sistemini tahriş eder. Buharlarının solunması öksürüğe, nefes darlığına ve akciğer tahrişine neden olabilir. Cilt ile temasında kaşıntı ve kızarıklığa neden olabilir. Bileşik dikkatle kullanılmalı ve eldiven ve göz koruması gibi koruyucu önlemler kullanılmalıdır. Maruz kalınması durumunda etkilenen bölgeler suyla durulanmalı ve semptomların devam etmesi halinde tıbbi yardıma başvurulmalıdır. Ayrıca yanıcıdır ve tutuşturucu kaynaklardan uzak tutulmalıdır.
| Tehlike sembolleri | Tahriş edici |
| Güvenlik Açıklaması | S26-S36/37/39 |
| BM kimlik numaraları | UN2672 |
| HS kodu | 2841.90.90 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | III |
| Toksisite | Gözleri, cildi ve solunum sistemini tahriş eder |
Amonyum oksit sentezi için yöntemler
(NH4)2O, amonyum nitratın termal ayrışması ve amonyak gazı ile oksijen gazı arasındaki reaksiyon dahil olmak üzere çeşitli yöntemlerle sentezlenebilir.
Yöntemlerden biri, yaygın bir gübre olan amonyum nitratın termal ayrışmasını içerir. Reaksiyon amonyak ve nitrojen dioksit üretir ve bunlar daha sonra nitrojen dioksit ve nitrik okside oksitlenir. Nitrik oksit daha fazla amonyak gazıyla reaksiyona girerek (NH4)2O oluşturur.
Başka bir yöntem, amonyak gazının ısıtılmış bir katalizör üzerinden geçirilmesini, nitrojen ve oksijen atomlarının birleşip (NH4)2O oluşturmasını sağlamayı içerir. Bu yöntemlerin her ikisi de, yeniden kristalleştirme yoluyla saflaştırılabilen beyaz kristalli bir katı halinde (NH4)2O üretir.
Amonyum oksit kullanımı
(NH4)2O, yüksek amonyum içeriği ve güçlü alkalin özelliği nedeniyle endüstrilerde çeşitli amaçlarla kullanılmaktadır. Gübre olarak bitkilere azot kaynağı sağlar. Temizlik maddeleri bunu yağ ve kiri çözmek için kullanır. Metalurji endüstrisi bunu özellikle alüminyum üretiminde metal oksitler için indirgeyici madde olarak kullanır. Soğutucu akışkan olarak endüstriyel soğutma sistemlerinde ve nitrik asit üretiminde nitrojen kaynağı olarak kullanılır. Laboratuvarda kimyagerler bunu kimyasal reaksiyonlar için amonyak kaynağı olarak kullanıyorlar. (NH4)2O’nun çok yönlülüğü, onu tüm sektörlerde çok sayıda uygulamaya sahip değerli bir kimyasal haline getirmektedir.
