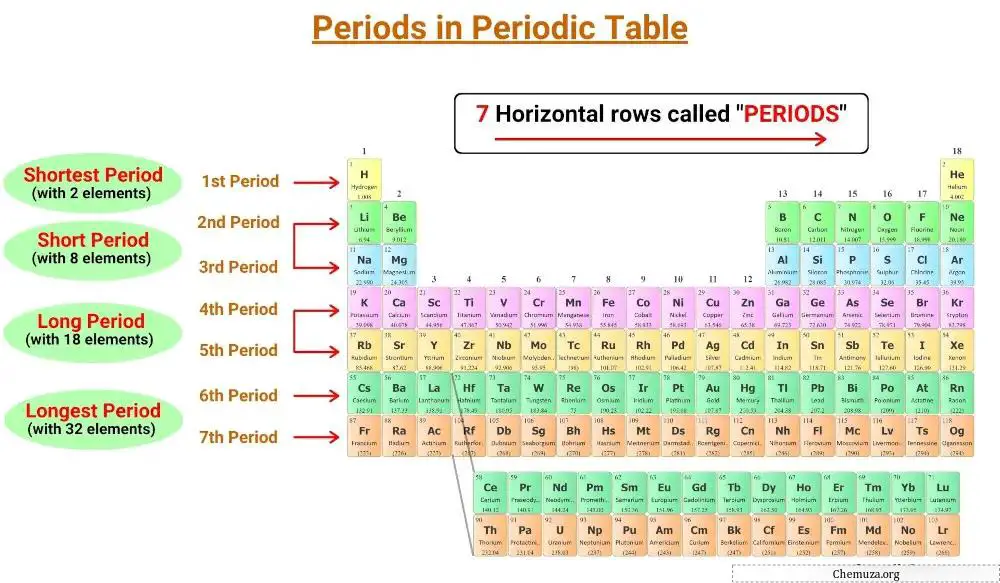
Periyodik tablonun yatay çizgilerine periyot denir ve periyodik tabloda 7 periyot vardır.
Aynı periyotta bulunan elementler aynı sayıda elektronik katmana sahiptir.
Periyodik tablodaki periyotları daha detaylı inceleyelim.
Periyodik tablodaki periyotlar nelerdir?
Periyodik tabloda noktalar soldan sağa yatay olarak uzanan çizgilerdir.
Periyodik tablo, benzer özelliklere sahip elementlerin grup veya aile adı verilen sütunlar halinde gruplandırılacağı, aynı dönemdeki elementlerin ise aynı sayıda elektron kabuğuna sahip olacağı şekilde düzenlenmiştir.
Periyodik tabloda 1’den 7’ye kadar numaralandırılmış yedi periyot vardır .[1]
Bir elementin kabuk sayısı ve periyot numarası
Bir elementin kabuk sayısı periyodik tablodaki periyodunu belirler.
Örneğin, 1. periyot elemanları yalnızca bir elektron kabuğuna sahipken, 2. periyot elemanları iki elektron kabuğuna sahiptir ve bu böyle devam eder.
Bu organizasyon, kimyagerlerin periyodik tablodaki konumuna göre bir elementin özelliklerini tahmin etmelerine yardımcı olur.
Periyotlardaki elementlerin özellikleri
Periyodik tablonun bir periyodunda ilerledikçe elementlerin çeşitli özellikleri öngörülebilir şekillerde değişir. Bunun nedeni elementlerin özelliklerinde gözlemlenen periyodik eğilimlerdir.
Atom yarıçapı:
Bir periyotta soldan sağa doğru gidildikçe atom yarıçapı genellikle azalır. [2]
Bunun nedeni, çekirdekteki proton sayısının artması, çekirdek ile en dış enerji seviyesindeki elektronlar arasında daha büyük bir çekim oluşmasına neden olmasıdır. Bu daha küçük bir atom yarıçapına neden olur.
Elektronegatiflik:
Elektronegatiflik , bir atomun kimyasal bir bağdaki elektronları kendine doğru çekme yeteneğinin ölçüsüdür.
Bir periyotta soldan sağa doğru gidildikçe elektronegatiflik genellikle artar. [3]
Bunun nedeni atom yarıçapının daha küçük olması ve çekirdeğin pozitif yükünün daha güçlü olması, onu negatif yüklü elektronlar için daha çekici hale getirmesidir.
İyonlaşma enerjisi:
İyonlaşma enerjisi, bir atomdan bir elektronu uzaklaştırmak için gereken enerji miktarıdır.
Bir periyotta soldan sağa doğru gidildikçe iyonlaşma enerjisi genellikle artar. [4]
Bunun nedeni, atom yarıçapının daha küçük olması ve elektronların çekirdek tarafından daha sıkı tutulmasıdır, bu da bir elektronun çıkarılmasını zorlaştırır.
Diğer özellikler:
Erime ve Kaynama Noktaları: Genellikle bir süre boyunca soldan sağa doğru artar, ancak bazı istisnalar vardır.
Metalik karakter: metal olmayanlar daha yaygın hale geldikçe, bir süre boyunca soldan sağa doğru azalır.
Reaktivite: Bir süre boyunca soldan sağa doğru hareket ettikçe elementler daha az reaktif hale gelir, çünkü elektronlar daha sıkı tutulur ve kimyasal reaksiyonlara katılma olasılıkları daha azdır.
Kimyada periyotların önemi
Periyodik tablonun periyotları elementlerin davranışlarını anlamak için önemlidir çünkü elementlerin elektronik konfigürasyonu ve diğer elementlerle nasıl etkileşime girdikleri hakkında bilgi sağlarlar. Kimyada dönemlerin önemli olmasının bazı nedenleri şunlardır:
- Özellikleri Tahmin Etme: Periyodik tablo, bilim adamlarının elementlerin özelliklerini tablodaki konumlarına göre tahmin etmelerine olanak tanır. Örneğin, aynı döneme ait elementler aynı sayıda elektron kabuğuna sahiptir; bu da onların atom boyutunu, reaktivitesini ve diğer özelliklerini tahmin etmeye yardımcı olabilir.
- Trendleri belirleyin: Periyodik tablodaki elementlerin düzeni, bilim adamlarının elementlerin özelliklerindeki eğilimleri belirlemesine olanak tanır. Örneğin, elektronegatiflik ve iyonlaşma enerjisi bir periyot boyunca soldan sağa doğru artma eğilimindeyken atom boyutu azalma eğilimindedir. Bu bilgi, elementlerin kimyasal reaksiyonlarda nasıl davrandığına dair tahminlerde bulunmak için kullanılabilir.
- Elementlerin Gruplandırılması: Periyodik tablo, elementleri özelliklerine göre metaller, ametaller ve metaloidler gibi kategorilere ayırır. Bu, bilim adamlarının elementler arasındaki benzerlikleri ve farklılıkları ve bunların birbirleriyle nasıl etkileşime girdiğini anlamalarına yardımcı olur.
- Yeni elementlerin keşfi: Periyodik tablo aynı zamanda bilim adamlarının yeni elementlerin varlığını ve özelliklerini tahmin etmelerine de yardımcı olur. Bilim insanları tablodaki boşlukları inceleyerek keşfedilmemiş elementlerin özelliklerini tahmin edebilir ve bunları laboratuvarda araştırabilir.
Özet
Periyodik tablonun periyot adı verilen yedi yatay çizgisi vardır. Aynı döneme ait elementler aynı sayıda elektronik katmana sahiptir. Periyodik tabloda 1’den 7’ye kadar numaralandırılmış yedi dönem vardır ve bir elementin kabuk sayısı o periyodu belirler.
Periyodik tablonun bir periyodunda ilerledikçe atom yarıçapı genellikle azalırken, elektronegatiflik ve iyonlaşma enerjisi genellikle artar. Erime ve kaynama noktaları, metalik karakter ve reaktivite gibi diğer özellikler de belirli bir süre içinde tahmin edilebileceği gibi değişir.
Periyodik tablonun periyotları elementlerin özelliklerini tahmin etmek, eğilimleri belirlemek, elementleri gruplamak ve yeni elementleri keşfetmek için önemlidir. Bilim insanları tablodaki boşlukları inceleyerek keşfedilmemiş elementlerin özelliklerini tahmin edebilir ve bunları laboratuvarda araştırabilir.
