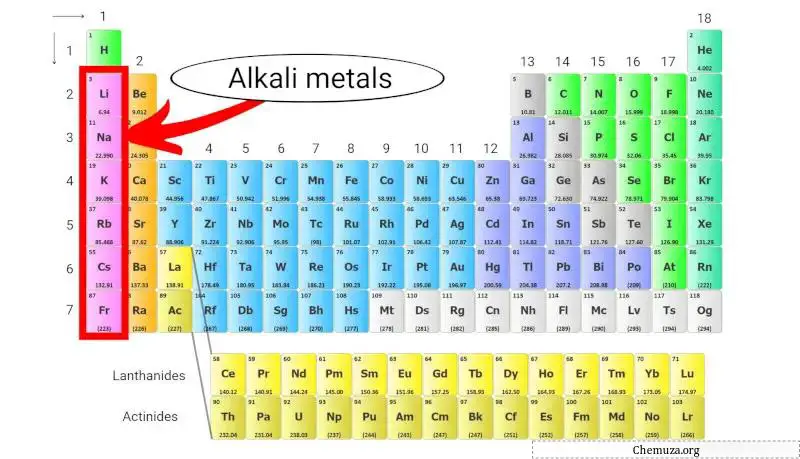
Alkali metaller periyodik tablonun ilk sütununda yer alan bir grup kimyasal elementtir. Bu grup lityum , sodyum , potasyum , rubidyum , sezyum ve francium’u içerir.
Alkali metaller yumuşaktır ve erime ve kaynama noktaları düşüktür. Pillerde, alaşımlarda ve çeşitli kimyasal reaksiyonlarda yaygın olarak kullanılırlar.
Periyodik tablodaki alkali metaller hakkında daha fazlasını keşfedelim.
Alkali metaller nelerdir?

Alkali metaller periyodik tablodaki grup 1’e ait bir grup kimyasal elementtir.
Bu elementler yumuşaklıkları, düşük erime noktaları, yüksek reaktiviteleri ve suyla reaksiyona girdiğinde alkali çözeltiler oluşturma yetenekleriyle bilinir.
Alkali metallerin temel özelliklerinden bazıları şunlardır:
- Düşük elektronegatifliklere ve iyonlaşma enerjilerine sahiptirler, bu da kolayca elektron kaybetme ve katyon oluşturma eğiliminde oldukları anlamına gelir.
- Düşük erime ve kaynama noktalarına sahiptirler, bu da onları nispeten yumuşak ve erimesi kolay hale getirir.
- Su ve oksijenle yüksek reaktiviteye sahiptirler, bu da onları hava ve suda reaktif hale getirir.
- Isı ve elektriği iyi iletirler.
Alkali metallere neden böyle deniyor?

Alkali metaller, su ile reaksiyona girdiklerinde güçlü alkali (bazik) çözeltiler oluşturabildikleri için bu şekilde adlandırılmıştır. [1]
Bu metaller suyla temas ettiğinde hidrojen gazı açığa çıkarırlar ve çözeltiye bazik bir pH veren hidroksit iyonları oluştururlar.
Açıklama:
Alkali metallerin su ile reaktivitesi düşük iyonizasyon enerjilerinden kaynaklanmaktadır [2] , bu da kolaylıkla elektron kaybedebilmeleri ve pozitif iyonlar (katyonlar) oluşturabilmeleri anlamına gelmektedir.
Su ile temasa geçtiklerinde kimyasal bir reaksiyona girerek elektronlarını kaybederler ve su molekülleri ile reaksiyona girerek hidroksit iyonları ve hidrojen gazı oluştururlar.
Bu reaksiyon, hidrojen gazının tutuşmasına ve patlamasına neden olabilecek çok fazla ısı açığa çıkarır.
Alkali metallerin reaktivite sırası
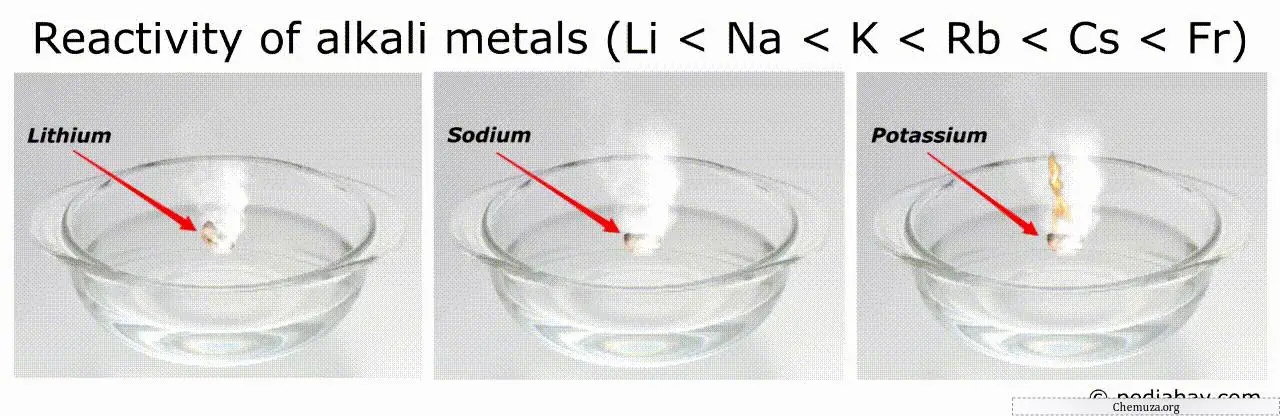
Alkali metallerin reaktivite sıralamasındaki genel eğilim, grupta lityumdan (Li) fransiyuma (Fr) doğru gidildikçe artmasıdır.
Bu, fransiyumun tüm alkali metaller arasında en reaktif olduğu, lityumun ise en az reaktif olduğu anlamına gelir.
Bu eğilimin nedeni grupta aşağıya doğru gidildikçe elementlerin atom yarıçaplarının artması, iyonlaşma enerjilerinin azalmasıdır.
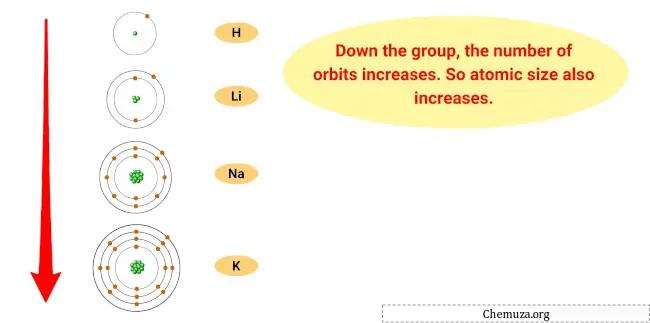
Bu, atomun en dıştaki elektronunun çekirdekten daha uzakta olduğu ve daha az sıkı tutulduğu anlamına gelir; bu da elementin bu elektronu kaybedip katyona dönüşmesini kolaylaştırır.
Grubun en büyüğü ve en az akrabası olan Fransiyum bu nedenle en reaktif olanıdır.
Bu reaktivite sırasının alkali metallerin özellikleri ve davranışları üzerinde önemli etkileri vardır.
Örneğin, en reaktif metaller (fransiyum ve sezyum gibi) havada veya suda kendiliğinden tutuşabilir, bu da bunların işlenmesini çok tehlikeli hale getirir.[3]
Tersine, daha az reaktif metaller (lityum gibi) daha kararlıdır ve daha kararlı bir metal gerektiren uygulamalarda kullanılabilir.
Alkali metallerin listesi ve elektronik konfigürasyonları
Alkali metaller ve elektronik konfigürasyonları aşağıda gösterilmiştir.
| Öğe | Elektronik konfigürasyon |
| Lityum (Li) | [O] 2s 1 |
| Sodyum (Na) | [Yap] 3s 1 |
| Potasyum (K) | [Ar] 4s 1 |
| Rubidyum (Rb) | [Kr] 5s 1 |
| Sezyum (Cs) | [Xe] 6s 1 |
| Fransiyum (Fr) | [Rn] 7s 1 |
Alkali metallerdeki periyodik eğilimler
Alkali metallerin periyodik eğilimleri aşağıda belirtilmiştir:
- Değerlik Eğilimi: Alkali metallerin değerliği her zaman +1’dir, yani kararlı bir katyon oluşturmak için bir elektron kaybetme eğilimindedirler. Bu nedenle grupta aşağıya doğru inildikçe alkali metallerin değerinde herhangi bir değişiklik olmaz. Hepsi aynı değerliliğe sahiptir (yani 1).
- Atom boyutu eğilimi: Alkali metallerin atom boyutu grupta aşağı doğru inildikçe artar, bu da atomların büyüdüğü anlamına gelir. Bunun nedeni, enerji seviyelerini ekledikçe elektron bulutunun boyutunun artmasıdır.
- Metalik Karakter Trendi: Alkali metallerin metalik karakteri grupta aşağıya doğru gidildikçe artar. Bunun nedeni, metallerin daha elektropozitif hale gelmesi ve metalik bağlar oluşturmak için elektron verme yeteneğinin daha fazla olmasıdır.
- Elektronegatiflik Eğilimi: Alkali metallerin elektronegatifliği grupta aşağıya doğru inildikçe azalır. Bunun nedeni atomların büyümesi ve dıştaki elektronların çekirdekten uzaklaşması ve dolayısıyla çekirdek tarafından daha az etkilenmeleridir.
- Elektron İlgi Eğilimi: Alkali metallerin elektron ilgisi grupta aşağıya doğru gidildikçe azalır. Aslında grubun alt kısmında atomların boyutu artar, bu da atomun elektronu kabul etme eğilimini azaltır. (Ayrıntılı bir anlayış için burada elektron ilgisi eğilimi hakkında daha fazla bilgi edinin).
- İyonlaşma Enerjisi Trendi: Alkali metallerin iyonlaşma enerjisi grupta aşağıya doğru gidildikçe azalır. Bu, elektronları atomun en dış kabuğundan çıkarmanın daha kolay olduğu anlamına gelir çünkü elektronlar çekirdekten daha uzaktadır ve daha az sıkı tutulur.
Özet
Alkali metaller, yumuşaklıkları, düşük erime noktaları, yüksek reaktiviteleri ve suyla reaksiyona girdiğinde alkali çözeltiler oluşturma yetenekleriyle bilinen bir grup kimyasal elementtir.
Alkali metallerin reaktivite sırası, artan atom yarıçapı ve azalan iyonlaşma enerjisi nedeniyle grupta lityumdan fransiyuma doğru ilerledikçe artar.
Alkali metallerdeki periyodik eğilimler, grupta aşağıya doğru ilerledikçe atom boyutunda ve metalik karakterde bir artışın yanı sıra elektronegatiflik, elektron ilgisi ve iyonlaşma enerjisinde bir azalmayı içerir.
Alkali metallerin değerliği her zaman +1’dir ve elektronik konfigürasyonları [soylu gaz] ns 1 modelini takip eder.
