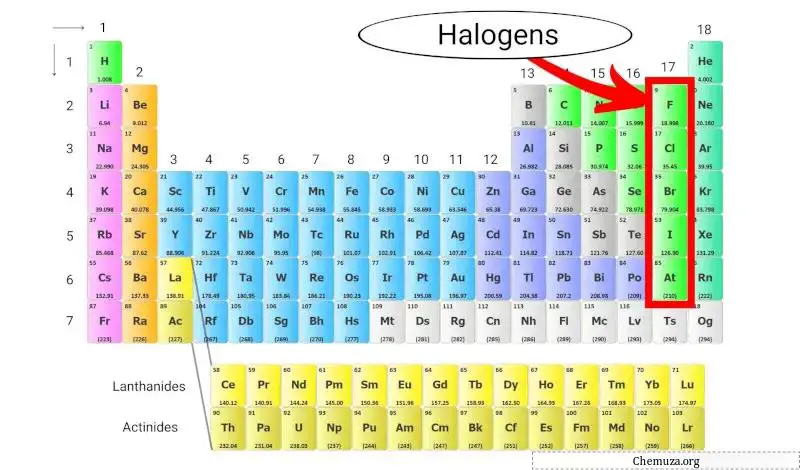
Halojenler, periyodik tablonun 17. grubunda (halojen grubu olarak da adlandırılır) bulunan bir grup elementtir. Halojenler beş farklı element içerir: flor (F), klor (Cl), brom (Br), iyot (I) ve astatin (At).
Halojenler benzersizdir çünkü periyodik tablodaki diğer tüm elementlerle bileşik oluşturabilen tek element grubudurlar.
Halojenleri daha detaylı inceleyelim.
Halojenler nelerdir? Ve neden onlara böyle deniyor?
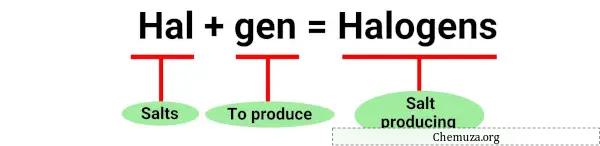
Halojen terimi, Yunanca tuz anlamına gelen “halos” ve üretici anlamına gelen “genes” sözcüklerinden türetilmiştir. [1]
Aslında halojenler ilk olarak metallerle reaksiyona girdiğinde tuz üretme yetenekleri sayesinde keşfedildi.
Örneğin:
Klor ( Cl2 ) sodyum (Na) ile reaksiyona girdiğinde yaygın bir sofra tuzu olan sodyum klorür (NaCl) oluşturur:
2Na + Cl2 → 2NaCl
Benzer şekilde brom ( Br2 ) potasyum (K) ile reaksiyona girdiğinde potasyum bromür (KBr) oluşturur:
2K + Br2 → 2KBr
Bu reaksiyonlar, metallerle reaksiyona girdiğinde tuz üreten halojenlerin örnekleridir, dolayısıyla “halojen” adı verilir.
Periyodik tablodaki en reaktif halojen
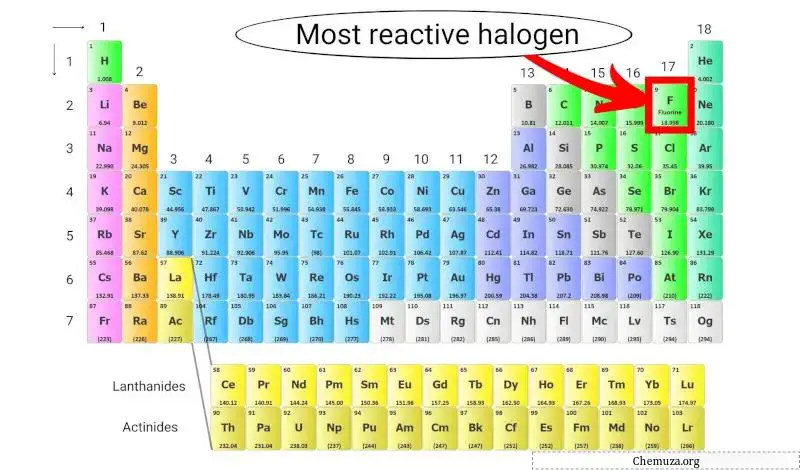
Flor en reaktif halojendir çünkü periyodik tablodaki tüm elementlerin elektronegatifliği en yüksek olanıdır, bu da elektronlar için güçlü bir çekime sahip olduğu anlamına gelir.
Bu, onu çok reaktif hale getirir ve periyodik tablodaki hemen hemen tüm diğer elementlerle reaksiyona girerek bileşikler oluşturabilme yeteneğine sahiptir. [2]
Basitçe söylemek gerekirse, flor elektronlar için bir mıknatıs gibidir ve bir elektron kazanıp dış kabuğunu tamamlamak için elinden geleni yapacaktır.
Bunu diğer elementlerle reaksiyona girerek ve onların elektronlarını çalarak yeni bileşikler oluşturarak yapar.
Florun bu kadar reaktif olmasının ve doğada asla elementel formda bulunmamasının, her zaman bileşik olarak bulunmasının nedeni budur.
Yüksek reaktivitesi nedeniyle florür de son derece tehlikelidir ve kullanımı güvensiz olabilir.
Genellikle özel laboratuvarlarda işlenir ve endüstriyel işlemlerde çok çeşitli kimyasallar ve malzemeler üretmek için kullanılır.
Halojenlerin reaktivitesi
Halojenler yüksek elektronegatifliklerinden dolayı çok reaktiftirler, bu da elektronları çekme yeteneklerinin çok yüksek olduğu anlamına gelir.
Ek olarak halojenlerin en dış kabuklarında 7 elektron vardır ve bu kabuğu doldurmak ve soy gazlar gibi kararlı bir elektronik konfigürasyona ulaşmak için yalnızca bir ekstra elektrona ihtiyaç duyarlar.
Örneğin flor için Bohr diyagramının en dış kabuğunda 7 elektron bulunduğunu görebilirsiniz.
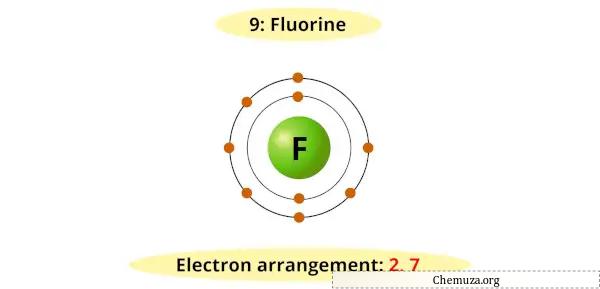
Artık kararlı bir oktet (7 + 1 = 8) elde etmek için 1 ek elektron gerekir.
Halojenler metallerle reaksiyona girerek metal halojenürler adı verilen ve parlak, renkli alevler üretebilen iyonik bileşikler oluşturur.
Ayrıca hidrojen , kükürt ve nitrojen gibi metal olmayan maddelerle de reaksiyona girerek çeşitli kovalent bileşikler oluştururlar. [3]
Bu nedenle halojenlerin bir elektron kazanma ve kararlı bir soy gaz konfigürasyonu elde etme eğilimi, onları çok reaktif ve diğer elementlerle bileşik oluşturabilme yeteneğine sahip kılar.
Periyodik Halojen Trendleri
Grupta aşağıya doğru gidildikçe halojen elementlerin kimyasal özelliklerinin yanı sıra fiziksel özelliklerinde de değişiklikler görülür.
Halojenlerin bazı özelliklerindeki eğilimlere bakalım.
- Atom boyutu: Grupta aşağıya doğru inildikçe halojenlerin atom boyutu artar. Bunun nedeni, her halojenin, üstündeki enerji seviyesinden bir fazla enerji seviyesine sahip olmasıdır; bu, en dıştaki elektronların çekirdekten daha uzakta olduğu anlamına gelir.
- Elektronegatiflik: Grupta aşağı doğru gidildikçe halojen elementlerin elektronegatifliği azalır. Bu, flor ve klor gibi grubun tepesindeki halojenlerin daha elektronegatif olduğu ve dolayısıyla iyot ve astatin gibi alttakilere göre elektron çekme olasılıklarının daha yüksek olduğu anlamına gelir.
- Erime Noktaları ve Kaynama Noktaları: Grupta aşağıya doğru gidildikçe halojenlerin erime ve kaynama noktaları artar. Aslında daha büyük atomlar daha fazla elektrona sahiptir ve daha güçlü moleküller arası kuvvetler oluşturma kapasitesine sahiptir. [4]
- Metallere karşı reaktivite: Grupta aşağıya doğru gidildikçe halojenlerin metallere karşı reaktivitesi azalır. Bu, flor ve klor gibi grubun tepesindeki halojenlerin, iyot ve astatin gibi alttaki halojenlere göre metallerle reaksiyona girme olasılığının daha yüksek olduğu anlamına gelir.
Özet
Halojenler, periyodik tablonun 17. grubunda bulunan beş elementten (flor, klor, brom, iyot ve astatin) oluşan bir gruptur. Diğer tüm elementlerle bileşik oluşturma yetenekleri bakımından benzersizdirler.
Halojenler, yüksek elektronegatiflikleri ve kararlı bir soy gaz konfigürasyonu elde etmek için elektron kazanma eğilimleri nedeniyle çok reaktiftir. Flor, yüksek elektronegatifliği nedeniyle en reaktif halojendir.
Grupta aşağıya doğru gidildikçe halojenlerin fiziksel ve kimyasal özelliklerinde atom boyutunda artış, elektronegatiflikte azalma, erime ve kaynama noktalarında artış gibi değişiklikler görülür. Halojenlerin metallere karşı reaktivitesi de grupta aşağıya doğru gidildikçe azalır.
