Bakır bromür (CuBr2), bakır ve bromdan yapılmış bir bileşiktir. Genellikle organik sentezlerde ve Lewis asidi katalizörü olarak kullanılan mavi-yeşil bir renk sergiler.
| IUPAC Adı | Bakır(II) bromür |
| Moleküler formül | CuBr2 |
| CAS numarası | 7789-45-9 |
| Eş anlamlı | Bakır bromür, bakır dibromür |
| InChI | InChI=1S/Br2.Cu |
Bakır bromürün özellikleri
Bakır Bromür Formülü
Kuprik bromürün formülü CuBr2’dir. Bir bakır atomu ve iki brom atomundan oluşan bir bileşiği temsil eder. Bu kombinasyon, çeşitli kimyasal reaksiyonlarda yaygın olarak kullanılan mavi-yeşil kristalli bir maddeyle sonuçlanır.
Bakır Bromür Molar Kütlesi
Kuprik bromürün molar kütlesi mol başına yaklaşık 223.36 gramdır. Bu değer, CuBr2 formülünde bulunan bir bakır atomunun (Cu) ve iki bromin atomunun (Br) atomik kütlelerinin eklenmesiyle elde edilir.
Bakır bromürün kaynama noktası
Kuprik bromürün kaynama noktası yaklaşık 1.294 santigrat derecedir (yaklaşık 2.361 derece Fahrenheit). Bu sıcaklık, maddenin standart atmosfer basıncı altında sıvıdan gaza dönüştüğü noktayı gösterir.
Bakır bromürün erime noktası
Kuprik bromürün erime noktası yaklaşık 498 santigrat derecedir (yaklaşık 928 Fahrenheit derece). Bu sıcaklık, katı maddenin ısıtıldığında sıvı duruma geçtiği noktayı temsil eder.
Bakır bromürün yoğunluğu g/mL
Kuprik bromürün yoğunluğu, standart oda sıcaklığında ve atmosfer basıncında mililitre başına yaklaşık 4,71 gramdır (g/mL). Bu değer, maddenin birim hacmi başına mevcut kütle miktarını ortaya koymaktadır.
Bakır Bromür Molekül Ağırlığı
Kuprik bromürün molekül ağırlığı mol başına yaklaşık 223,36 gramdır. Bu değer, çeşitli kimyasal hesaplamalar için çok önemlidir ve belirli bir numunede bulunan madde miktarı için bir referans görevi görür.
Bakır bromürün yapısı
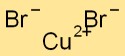
Kuprik bromür, bakır atomlarının bromin atomları ile çevrelendiği ve bunun tersinin de geçerli olduğu bir kristal kafes yapısına sahiptir. Bu düzenleme, bileşiğin fiziksel özelliklerine katkıda bulunan kararlı ve düzenli bir model oluşturur.
Bakır bromürün çözünürlüğü
Bakır bromürün suda çözünürlüğü sınırlıdır. Organik çözücülerde daha fazla çözünür. Çözünürlük sıcaklık ve kullanılan çözücünün doğası gibi faktörlere bağlıdır. Çözünürlüğünü anlamak kimya ve endüstrideki çeşitli uygulamalar için hayati öneme sahiptir.
| Dış görünüş | Mavi-yeşil kristaller |
| Spesifik yer çekimi | Müsait değil |
| Renk | Mavi-yeşil |
| Koku | Kokusuz |
| Molar kütle | 223,36 gr/mol |
| Yoğunluk | 4,71 gr/ml |
| Füzyon noktası | 498°C (928°F) |
| Kaynama noktası | 1294°C (2361°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Sınırlı çözünürlük |
| çözünürlük | Etanol, eter ve benzen gibi organik çözücülerde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Müsait değil |
Bakır bromürün güvenliği ve tehlikeleri
Kuprik bromür belirli güvenlik ve tehlike hususlarını beraberinde getirir. Potansiyel toksisitesi ve tahriş edici özellikleri nedeniyle bu bileşiğin dikkatle kullanılması önemlidir. Cilt veya gözlerle doğrudan temas tahrişe ve rahatsızlığa neden olabilir. Tozunun veya dumanının solunması solunum yollarını tahriş edebilir. Bu nedenle bakır bromür ile çalışırken eldiven ve gözlük gibi uygun kişisel koruyucu ekipmanlar giyilmelidir. Ayrıca potansiyel reaksiyonları önlemek için uyumsuz maddelerden uzakta saklanmalıdır. Yutulması veya kazara maruz kalması durumunda derhal tıbbi yardıma başvurun. Kuprik bromürün güvenli bir şekilde taşınmasını ve kullanılmasını sağlamak için güvenlik önlemlerine uymak çok önemlidir.
| Tehlike sembolleri | Tahriş edici, Aşındırıcı |
| Güvenlik Açıklaması | Depozito ile işlem yapın. Cilt ve gözlerle doğrudan temasından kaçının. Uygun koruyucu ekipman kullanın. |
| BM kimlik numaraları | Müsait değil |
| HS kodu | Müsait değil |
| Tehlike sınıfı | Tahriş edici |
| Paketleme grubu | Müsait değil |
| Toksisite | Cilt ve göz tahrişine neden olabilir. Toz veya dumanın solunması solunum yollarını tahriş edebilir. |
Bakır bromürün sentezi için yöntemler
Kuprik bromürü (CuBr2) sentezlemek için çeşitli yöntemler vardır. Yaygın bir yaklaşım, metalik bakır veya bakır oksidin hidrobromik asitle doğrudan kombinasyonunu içerir. Bu yöntemde aside bakır ekliyoruz ve kimyasal reaksiyona girerek bakır bromürün oluşmasına ve hidrojen gazının açığa çıkmasına neden oluyoruz.
Diğer bir yöntem ise bakır karbonat veya bakır hidroksitin hidrobromik asit ile reaksiyonudur. Karbonat veya hidroksit asitle reaksiyona girerek bakır bromür, su ve karbon dioksit üretir.
Ek olarak kuprik bromürü sentezlemek için çift yer değiştirme reaksiyonu kullanılabilir. Bu yöntem, bakır sülfat gibi çözünür bir bakır tuzu ile sodyum bromit gibi çözünür bir bromür tuzu arasındaki reaksiyonu içerir. Reaksiyon, kuprik bromürün ve reaksiyonda mevcut olan diğer metal veya metaloidin çözünür bir tuzunun oluşumuna yol açar.
Ek olarak bakır bromürü sentezlemek için elektrokimyasal yöntemler kullanabiliriz. Bu yöntemler, bakır elektrotlara ve bir bromür iyon kaynağına sahip bir elektrokimyasal hücrenin kullanımını içerir. Akım uyguladığımızda bir elektrotta bakır bromür oluşurken diğer elektrotta brom gazı açığa çıkar.
Sentez yönteminin seçimi, reaktiflerin mevcudiyeti, istenen saflık ve reaksiyonun kapsamı gibi faktörlere bağlıdır. Tüm sentetik prosedürler sırasında uygun kullanım ve güvenlik önlemlerine uyulmalıdır.
Bakır bromürün kullanım alanları
Bakır bromür (CuBr2), benzersiz özelliklerinden dolayı çeşitli endüstrilerde çok yönlü uygulamalar bulur. İşte dikkate değer kullanımlarından bazıları:
- Organik sentez : Kuprik bromür, Ullmann eşleşmesi ve Wurtz-Fittig reaksiyonu gibi birçok organik reaksiyonda katalizör görevi görerek karbon-karbon ve karbon-heteroatom bağlarının oluşumuna izin verir.
- Fotoğrafçılık : Fotoğrafik işlemlerde emülsiyonları hassaslaştırmak ve film ve plakaların hassasiyetini arttırmak, böylece yüksek kaliteli görüntülerin yakalanmasını kolaylaştırmak için kullanılır.
- Elektrokaplama : Bakır bromür, elektrokaplama işlemlerinde yüzeylere bakır katmanları biriktirmek, korozyon direnci ve dekoratif kaplamalar sağlamak için kullanılır.
- Yarı iletken endüstrisi : Elektronik sektöründe optoelektronik ve fotonik alanlarında uygulamaları olan kuprik bromit bazlı nanokristallerin sentezinde kullanılır.
- Alev Boyası : Bakır bromür, piroteknikte ve havai fişeklerde yeşil bir alev rengi üretmek için kullanılır ve gösterilere görsel çekicilik katar.
- Tıp : Sınırlı olmasına rağmen antibakteriyel özelliklerinden dolayı potansiyel terapötik uygulamalar için araştırılmıştır.
- Lazer Teknolojisi : Bakır bromür lazerler bilimsel araştırmalarda, lazer kaynaklı floresans çalışmalarında ve yüksek enerjili lazer darbeleri üretmek için kullanılır.
- Kimyasal analiz : Analitik kimyada kalitatif ve kantitatif analizler için kullanılır.
- Brominasyon reaksiyonları : Bakır bromür, brominasyon maddesi olarak görev yapar ve bromun organik bileşiklere eklenmesini kolaylaştırır.
- Litografi : Litografik işlemlerde, bakır bromür bileşiklerinin mikro ve nano imalat tekniklerinde kullanılması araştırılmıştır.
Kuprik bromürün çeşitli uygulamaları, çeşitli alanlardaki önemini ortaya koymakta ve onu endüstriyel ve bilimsel çalışmalarda değerli bir bileşik haline getirmektedir.
Sorular:
S: Bakır(II) bromürün molar kütlesi nedir?
C: Kuprik(II) bromürün molar kütlesi yaklaşık 223,36 g/mol’dür.
S: Bakır(II) bromürün formülü nedir?
C: Kuprik(II) bromürün formülü CuBr2’dir.
S: Bakır(II) bromür suda çözünür mü?
C: Cupric(II) bromürün suda çözünürlüğü sınırlıdır.
S: Bakır(II) bromür ne için kullanılır?
C: Bakır(II) bromür, organik sentez, fotoğrafçılık, elektrokaplama ve yarı iletken endüstrisinde katalizör olarak kullanılır.
S: Çinko ve bakır bromür tek seferlik bir değişim midir?
C: Evet, çinko ve kuprik(II) bromür tek bir yer değiştirme reaksiyonuna girerek çinko bromür ve metalik Cu üretir.
S: Baryum asetat ve bakır(II) bromürün sulu çözeltileri birleştirildiğinde bir reaksiyon meydana gelir mi?
C: Evet, baryum bromür ve bakır(II) asetat oluşumuyla sonuçlanan bir reaksiyon meydana gelir.
S: Suya bakır(II) bromür eklendiğinde hangi iyonlar oluşur?
C: Kuprik(II) bromür suya eklendiğinde Cu^2+ iyonlarına ve bromür (Br^-) iyonlarına ayrışır.
S: CuBr2 iyonik bir bağ oluşturur mu?
C: Evet, CuBr2 bakır ve brom iyonları arasında iyonik bir bağ oluşturur.
S: CuBr2 kovalent bir bağ oluşturur mu?
C: Hayır, CuBr2 kovalent bir bağ oluşturmaz.
S: CuBr2 suda çözünür mü?
C: CuBr2’nin suda çözünürlüğü sınırlıdır.
S: CuBr2 nedir?
C: CuBr2, mavi-yeşil kristalli bir bileşik olan kuprik(II) bromürün kimyasal formülüdür.
S: CuBr2 çözünür mü yoksa çözünmez mi?
C: CuBr2 suda az çözünür.
S: CuBr2’deki bakırın kütle yüzdesi nedir?
C: CuBr2’deki bakırın kütle yüzdesi yaklaşık %47,5’tir.
