Bakır hidroksit (Cu(OH)2), bakır tuzlarının hidroksit iyonlarıyla reaksiyonu sonucu oluşan mavi bir katıdır. Mantar ilacı olarak ve çeşitli kimyasal işlemlerde kullanılır.
| IUPAC Adı | Bakır(II) hidroksit |
| Moleküler formül | Cu(OH)2 |
| CAS numarası | 20427-59-2 |
| Eş anlamlı | Bakır hidroksit; Bakır dihidroksit; CuOH2 |
| InChI | InChI=1S/Cu.2H2O/h;2*1H2/q+2;;/p-2 |
Bakır hidroksitin özellikleri
Bakır Hidroksit Formülü
Kuprik hidroksitin kimyasal formülü Cu(OH)2’dir. İyonik bağlarla bir arada tutulan bir bakır iyonu (Cu2+) ile iki OH-iyonunun birleşimini temsil eder. Bu mavi katı bileşik, benzersiz özelliklerinden dolayı çeşitli endüstrilerde yaygın olarak kullanılmaktadır.
Bakır Hidroksit Molar Kütlesi
Kuprik hidroksitin (Cu(OH)2) molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Bakırın (Cu) atom kütlesi yaklaşık 63,55 g/mol’dür ve her bir OH-iyonunun birleşik atom kütlesi yaklaşık 17,01 g/mol’dür. Bu nedenle bakır hidroksitin molar kütlesi yaklaşık 97,55 g/mol’dür.
Bakır hidroksitin kaynama noktası
Bakır hidroksitin belirgin bir kaynama noktası yoktur çünkü kaynama noktasına ulaşmadan ayrışır. Isıtıldığında, bakır oksit ve su buharı oluşturmak üzere termal bir ayrışma reaksiyonuna girer.
Bakır hidroksitin erime noktası
Bakır hidroksitin erime noktası yaklaşık 200°C’dir (392°F). Bu sıcaklıkta katı faz geçişine uğrar ve sıvı hale dönüşür.
Bakır hidroksitin yoğunluğu g/mL
Kuprik hidroksitin yoğunluğu yaklaşık 3,36 g/mL’dir. Bu değer, bir mililitre bakır hidroksitin kütlesini temsil eder ve onun kompaktlığını ve konsantrasyonunu gösterir.
Bakır Hidroksit Molekül Ağırlığı
Kuprik hidroksitin moleküler ağırlığı yaklaşık 97,55 g/mol’dür. Bir bakır hidroksit molekülünde bulunan tüm atomların atom ağırlıkları toplanarak hesaplanır.
Bakır hidroksitin yapısı
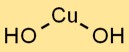
Bakır hidroksit, Cu2+ iyonlarının trigonal düzlemsel bir düzenlemede OH- iyonları ile çevrelendiği kristal bir yapıya sahiptir. Bu kristal kafes düzenlemesi stabilitesine ve ayırt edici özelliklerine katkıda bulunur.
Bakır hidroksitin çözünürlüğü
Bakır hidroksitin suda çözünürlüğü sınırlıdır. Suda çok az çözünen bir süspansiyon oluşturur; bu, bileşiğin yalnızca küçük bir miktarının solvent içinde çözündüğü anlamına gelir. Çözünürlük sıcaklık ve pH gibi faktörlerden etkilenebilir.
| Dış görünüş | Katı mavi |
| Spesifik yer çekimi | ~3,36 g/mL |
| Renk | Mavi |
| Koku | Kokusuz |
| Molar kütle | ~97,55 gr/mol |
| Yoğunluk | ~3,36 g/mL |
| Füzyon noktası | ~200°C (392°F) |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Yok |
| sudaki çözünürlük | Az çözünür |
| çözünürlük | Sınırlıdır, sıcaklık ve pH seviyelerine göre değişir |
| Buhar basıncı | Yok |
| Buhar yoğunluğu | Yok |
| pKa | Yok |
| pH | Alkali (temel) |
Bakır Hidroksitin Güvenliği ve Tehlikeleri
Bakır hidroksit bazı güvenlik ve tehlike hususlarını beraberinde getirir. Genellikle düşük toksisiteye sahip olduğu kabul edilir, ancak temas veya solunması halinde ciltte, gözlerde ve solunum yollarında tahrişe neden olabilir. Bu bileşiği kullanırken eldiven ve koruyucu gözlük takmak gibi yeterli koruyucu önlemler alınmalıdır. Yutma veya kazara maruz kalma durumunda derhal tıbbi müdahale gereklidir. Ek olarak bakır hidroksit, uyumsuz maddelerden uzakta, güvenli ve iyi havalandırılan bir alanda saklanmalıdır. Çevrenin kirlenmesini önlemek için uygun imha prosedürleri takip edilmelidir. Bakır hidroksitle ilişkili potansiyel riskleri en aza indirmek için güvenlik önlemlerine uymak çok önemlidir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | Düşük toksisite; Tahriş edici |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2825.90.5000 |
| Tehlike sınıfı | Tehlikeli olarak sınıflandırılmadı |
| Paketleme grubu | sınıflandırılmamış |
| Toksisite | Zayıf |
Bakır hidroksit sentez yöntemleri
Kuprik hidroksitin sentezlenmesi için çeşitli aktif yöntemler vardır.
Yaygın bir yaklaşım, CuSO4 gibi bir Cu tuzunun, sodyum hidroksit (NaOH) veya potasyum hidroksit (KOH) gibi güçlü bir bazla reaksiyonunu içerir. Bu işlem sırasında bazdan gelen hidroksit iyonları (OH-), CuSO4’teki sülfat iyonlarının (SO4^2-) yerini alarak mavi bir çökelti halinde bakır hidroksit (Cu(OH)2) oluşturur.
Başka bir yöntem, bir bakır(II) tuzunun amonyak (NH3) ile reaksiyonunu içerir. Bir Cu(II) çözeltisine amonyak eklendiğinde, Cu2+ iyonlarının amonyağın hidroksit iyonları ile birleşimi nedeniyle bakır hidroksit çökelir.
Elektroliz, bir Cu elektrotunun bir elektrolit çözeltisine daldırılması ve doğrudan elektrik akımı uygulanması yoluyla bakır hidroksitin sentezine izin verir. Katotta suyun indirgenmesi hidroksit iyonları üreterek bakır hidroksit oluşumuna yol açar.
Bu aktif sentez yöntemleri, çeşitli endüstriyel ve araştırma uygulamaları için bakır hidroksit üretmenin kontrollü ve etkili yollarını sağlar.
Bakır hidroksitin kullanım alanları
Bakır hidroksit, benzersiz özellikleri ve çok yönlü yapısı nedeniyle çeşitli endüstrilerde birçok uygulama alanı bulur. Bazı dikkate değer kullanımlar şunları içerir:
- Mantar ilacı: Çiftçiler bunu meyve, sebze ve süs bitkileri gibi ürünlerdeki mantar hastalıklarını kontrol etmek için koruyucu bir mantar ilacı olarak yaygın olarak kullanırlar.
- Kimyasal Ara Maddeler: Bakır oksit ve bakır tuzları gibi çeşitli bakır bileşiklerinin sentezinde değerli bir kimyasal ara madde olarak hizmet eder.
- Ahşap koruyucu: Ahşabı işleyerek ahşabı yiyen böceklere ve çürümeye neden olan mantarlara karşı koruma sağlayarak ahşap yapıların ömrünü uzatır.
- Antibakteriyel madde: Bazı formülasyonlarda antibakteriyel madde görevi görerek tıbbi ve sağlık hizmetlerinde uygulama alanı bulur.
- Su Arıtma: Göletler, göller ve diğer su kütlelerindeki alglerin ve suda yaşayan yabani otların yönetilmesine, ekolojik dengenin korunmasına yardımcı olur.
- Seramik ve cam endüstrisi: Üreticiler bunu seramik ve cam ürünlere canlı mavi ve yeşil tonlar kazandırmak için renklendirici olarak kullanıyor.
- Piroteknik: Havai fişek ve işaret fişeklerinin renklendirilmesine katkıda bulunur, piroteknik uygulamalarda rol oynar.
- Pil imalatı: Enerji depolamayı kolaylaştıran elektrot malzemesi olarak pil üretiminde kullanım alanı bulur.
- Boya ve Kaplamalar: Bazı boya formülasyonları, koruyucu ve antimikrobiyal özellikler kazandırmak için bunu içerir.
Uygulama çeşitliliği, bakır hidroksitin birçok endüstrideki önemini vurguluyor ve bu da onu çeşitli pratik kullanımlar için değerli bir bileşik haline getiriyor.
Sorular:
S: Bakır hidroksit çözünür mü?
C: Bakır hidroksitin suda çözünürlüğü sınırlıdır, bu da az çözünen bir süspansiyon oluşturur.
Soru: 68 gram bakır(II) hidroksit Cu(OH)2’de kaç mol vardır?
C: 68 gramda yaklaşık 0,697 mol Cu(OH)2 bulunur.
S: Bakır II hidroksit suda çözünür mü?
C: Cupric II hidroksitin suda çözünürlüğü sınırlıdır.
S: Sodyum hidroksit ve bakır sülfat kimyasal bir reaksiyon mudur?
C: Evet, NaOH ile CuSO4 arasındaki reaksiyon kuprik hidroksit ve sodyum sülfat oluşumuyla sonuçlanır.
S: Bakır(II) hidroksit çözünür mü?
C: Bakır(II) hidroksitin suda çözünürlüğü sınırlıdır.
Soru: Bakır hidroksitin rengi nedir?
Cevap: Bakır hidroksitin rengi mavidir.
Soru: Bakır hidroksit alkali midir?
C: Bakır hidroksit bir bazdır ancak alkali olarak sınıflandırılmaz.
S: Bakır hidroksit güçlü bir baz mıdır?
C: Bakır hidroksit güçlü bir baz olarak kabul edilmez.
S: Cu(OH)2 suda çözünür mü?
C: Cu(OH)2’nin suda çözünürlüğü sınırlıdır.
Soru: 68 gram bakır(II) hidroksit Cu(OH)2’de kaç mol vardır?
C: 68 gramda yaklaşık 0,697 mol Cu(OH)2 bulunur.
Soru: 34 gram Cu(OH)2’de kaç mol vardır?
C: 34 gramda yaklaşık 0,3485 mol Cu(OH)2 bulunur.
S: 0,075 g KOH, 1,0 L Cu(NO3)2 içinde 1,0 × 10^−3 M’de çözündüğünde katı bir Cu(OH)2 oluşur mu?
C: Evet, KOH ile Cu(NO3)2 arasındaki reaksiyon nedeniyle katı Cu(OH)2 çökelti olarak oluşur.
