Lityum bikarbonat (LiHCO3), çeşitli uygulamalarda kullanılan kimyasal bir bileşiktir. Alkali özelliklere sahiptir ve araştırmalarda, farmasötiklerde ve belirli tıbbi durumların potansiyel tedavisinde kullanılır.
| IUPAC Adı | Lityum bikarbonat |
| Moleküler formül | LiHCO3 |
| CAS numarası | 5006-97-3 |
| Eş anlamlı | Lityum hidrojen karbonat, Li bikarbonat |
| InChI | InChI=1S/CH2O3.Li/c2-1(3)4;/h(H2,2,3,4);/q;+1 |
Lityum bikarbonatın özellikleri
Lityum Bikarbonat Formülü
Lityum hidrojen karbonat, LiHCO3 kimyasal formülüne sahiptir. Bir lityum katyonu (Li), bir hidrojen karbonat anyonu (HCO3) ve bir hidrojen atomundan (H) oluşur. Formül, bileşikteki lityum ve bikarbonat iyonlarının varlığını yansıtır.
Lityum Bikarbonat Molar Kütlesi
Lityum hidrojen karbonatın (LiHCO3) molar kütlesi mol başına yaklaşık 68 gramdır (g/mol). Bileşen elementlerinin atomik kütleleri eklenerek hesaplanır: lityum, hidrojen, karbon ve oksijen.
Lityum bikarbonatın kaynama noktası
Lityum hidrojen karbonatın iyi tanımlanmış bir kaynama noktası yoktur çünkü yüksek sıcaklıklarda ayrışır. Isındıkça karbondioksit (CO2) ve su (H2O) kaybederek lityum karbonata (Li2CO3) dönüşür.
Lityum bikarbonat Erime noktası
Lityum hidrojen karbonatın erime noktası yaklaşık 250 santigrat derece (482 derece Fahrenheit)’tir. Bu sıcaklıkta katı halden sıvı hale faz geçişine uğrar.
Lityum bikarbonatın yoğunluğu g/mL
Lityum hidrojen karbonatın (LiHCO3) yoğunluğu mililitre başına yaklaşık 2,21 gramdır (g/mL). Lityum ve diğer ağır elementlerin varlığı nedeniyle nispeten yoğun bir bileşiktir.
Lityum Bikarbonat Molekül Ağırlığı
Lityum hidrojen karbonatın moleküler ağırlığı yaklaşık 68 g/mol’dür. Molekül ağırlığı, bileşiğin tek bir molekülündeki tüm atomların atom ağırlıklarının toplamını temsil eder.
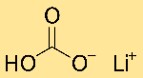
Lityum bikarbonatın yapısı
Lityum hidrojen karbonat kristal bir yapıya sahiptir. Tekrarlanan bir düzende düzenlenmiş lityum, hidrojen karbonat ve hidrojen atomlarından oluşan bir ağ oluşturur. Yapı iyonik ve kovalent bağlarla bir arada tutulur.
Lityum bikarbonatın çözünürlüğü
Lityum hidrojen karbonat suda çok az çözünür. Suda bir dereceye kadar çözünür ve hafif alkali bir çözelti verir. Ancak çözünürlüğü diğer lityum bileşiklerine göre nispeten düşüktür.
| Dış görünüş | Beyaz kristal toz |
| Spesifik yer çekimi | ~2,21 g/mL |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | ~68 gr/mol |
| Yoğunluk | ~2,21 g/mL |
| Füzyon noktası | ~250°C (482°F) |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Hafifçe çözünür, hafif alkali bir çözelti verir |
| çözünürlük | Sınır |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Hafif alkali |
Lityum bikarbonatın güvenliği ve tehlikeleri
Lityum hidrojen karbonatın belirli güvenlik hususları ve tehlikeleri vardır. Riskleri en aza indirmek için bileşiği dikkatli bir şekilde kullanmak önemlidir. Cilt veya gözlerle doğrudan temas tahrişe neden olabilir. Solunum rahatsızlığına neden olabileceğinden toz veya dumanın solunmasından kaçınılmalıdır. Isıtıldığında ayrışır ve kapalı alanlarda potansiyel olarak tehlikeli olabilecek karbondioksit ve su buharı açığa çıkarır. Ek olarak, lityum hidrojen karbonatın uyumsuz maddelerden uzakta uygun şekilde saklanması çok önemlidir. Güvenli bir ortam sağlamak için bu bileşikle çalışırken yeterli havalandırma ve kişisel koruyucu ekipman kullanılmalıdır.
| Tehlike sembolleri | Müsait değil |
| Güvenlik Açıklaması | Dikkatli tutun. Teneffüs etmekten, cilt ve gözlerle temasından kaçının. Düzgün saklayın. İyi havalandırılmış alanlarda kullanın. |
| BM kimlik numaraları | Müsait değil |
| HS kodu | Müsait değil |
| Tehlike sınıfı | Müsait değil |
| Paketleme grubu | Müsait değil |
| Toksisite | Düşük toksisite; depozito ile halledin. |
Lityum bikarbonatın sentezlenmesi için yöntemler
Çeşitli yöntemler lityum hidrojen karbonatın sentezine izin verir.
Yaygın bir yaklaşım, lityum hidroksitin (LiOH) karbon dioksit (CO2) ile reaksiyona sokulmasıdır. Reaksiyon, lityum hidroksitin lityum ve hidroksit iyonlarına ayrıştığı sulu bir çözelti içinde gerçekleşir. Aynı zamanda karbondioksit suda çözünerek karbonik asit (H2CO3) oluşturur. Lityum iyonları daha sonra karbonik asitle reaksiyona girerek lityum hidrojen karbonat (LiHCO3) ve su (H2O) üretir. Bu reaksiyonun kimyasal denklemi şöyledir:
LiOH + CO2 → LiHCO3 + H2O
Başka bir yöntem , lityum karbonatın (Li2CO3) kapalı bir sistemde karbon dioksit ile işlenerek lityum bikarbonat üretilmesini içerir. Bu reaksiyonun kimyasal denklemi şöyledir:
Li2CO3 + CO2 → 2LiHCO3
Bu sentez yöntemleri, laboratuvarda lityum hidrojen karbonatın üretimi ve endüstriyel uygulamalar için önemlidir. Sentez işlemi sırasında güvenlik protokollerini takip etmek ve uygun ekipman ve koşulları sağlamak çok önemlidir.
Lityum bikarbonatın kullanım alanları
Lityum hidrojen karbonat, benzersiz özelliklerinden dolayı birçok uygulama alanı bulur. İşte ana kullanımlarından bazıları:
- Araştırma ve Laboratuvar: Çeşitli kimyasal ve araştırma deneylerinde değerli bir reaktif görevi görerek bilim adamlarının kimyasal reaksiyonları ve özellikleri incelemesine olanak tanır.
- Potansiyel Tıbbi Tedavi: Lityum eksikliği ve bazı böbrek bozuklukları gibi hastalıkların tedavisinin yanı sıra alkalileştirici bir madde olarak potansiyel rolüne ilişkin çalışmalar devam etmektedir.
- Çevresel uygulamalar: Endüstriyel proseslerden karbondioksitin uzaklaştırılmasına katkıda bulunabilir ve sera gazı emisyonlarının azaltılmasında potansiyel uygulamalara sahiptir.
- Alkalileştirici Ajan: Belirli endüstriyel proseslerde asitliği kontrol etmek ve pH seviyelerini düzenlemek için alkalileştirici ajan olarak görev yapar.
- İlaç endüstrisi: Farmasötik formülasyonlar, öncelikle bipolar bozukluk gibi duygudurum bozukluklarına yönelik ilaçlarda lityum hidrojen karbonat kullanır.
- Lityum pil üretimi: Araştırmacılar ve deney çevreleri, pil performansını artırmak için gelişmiş lityum bazlı pillerde lityum hidrojen karbonatın kullanımını araştırıyorlar.
- Su Arıtma: Su arıtma prosesleri, su kaynaklarının pH’ını ayarlamak için lityum bikarbonat kullanır.
- Tarım: Lityum hidrojen karbonat, çiftçilerin belirli toprak koşullarını tedavi etmek ve bitki büyümesini iyileştirmek için kullandığı tarımsal uygulamalarda sınırlı kullanım alanı bulmaktadır.
Bu uygulamalara rağmen, potansiyel tehlikeleri ve reaktifliği göz önüne alındığında, lityum hidrojen karbonatın dikkatle kullanılması ve güvenlik önlemlerine uyulması çok önemlidir. Araştırmalar ve teknolojik gelişmeler devam ettikçe lityum hidrojen karbonatın yeni kullanım alanları ortaya çıkabilir ve çeşitli alanlardaki önemi daha da artabilir.
Sorular:
S: Lityum bikarbonatın kimyasal formülü nedir?
C: Lityum hidrojen karbonatın kimyasal formülü LiHCO3’tür.
S: Lityum bikarbonat düşük D vitaminine neden olabilir mi?
C: Lityum hidrojen karbonatın düşük D vitamini düzeylerine neden olduğunu gösteren hiçbir kanıt yoktur.
S: Hangisi daha iyi çalışır: lityum karbonat mı yoksa lityum bikarbonat mı?
C: Lityum karbonatın veya lityum bikarbonatın etkinliği, spesifik uygulamalarına ve kullanım amaçlarına bağlıdır.
S: Lityum bikarbonat kediotu ekstraktı ile etkileşime giriyor mu?
C: Lityum hidrojen karbonat ile kediotu ekstresi arasında bilinen bir etkileşim yoktur, ancak bir sağlık uzmanına danışılması önemlidir.
Soru: Lityum bikarbonat nedir?
C: Lityum hidrojen karbonat, araştırma ve farmasötikler de dahil olmak üzere çeşitli uygulamalarda kullanılan, alkali özelliklere sahip kimyasal bir bileşiktir.
S: Lityum bikarbonat ve lityum karbonat suda ısıtılabilir mi?
C: Lityum hidrojen karbonat ve lityum karbonat suda ısıtılabilir, ancak başka bileşikler oluşturmak üzere parçalanırlar.
S: 3,45 g LiHCO3 parçalandığında kilo kaybı ne kadar olur?
C: 3,45 g LiHCO3 ayrıştırıldığındaki ağırlık kaybı, spesifik reaksiyona ve oluşan ürünlere bağlı olacaktır.
S: LiHCO3 güçlü bir elektrolit midir?
C: Hayır, lityum hidrojen karbonat (LiHCO3) zayıf bir elektrolittir.
S: H2SO4’ün LiHCO3 ile reaksiyonundan hangi tuz üretilir?
C: H2SO4 ile LiHCO3 arasındaki reaksiyon lityum sülfat (Li2SO4), karbondioksit (CO2) ve su (H2O) üretecektir.
S: LiHCO3 asit mi yoksa baz mı?
C: Lityum hidrojen karbonat (LiHCO3), alkalin özelliklerinden dolayı baz görevi görür.
S: N-metiletanamin LiHCO3 ile reaksiyona girer mi?
C: N-metiletanaminin LiHCO3 ile reaktivitesi spesifik reaksiyon koşullarına ve istenen ürünlere bağlı olacaktır.
