Lityum oksit (Li2O), lityum ve oksijenden oluşan bir bileşiktir. Güçlü iyonik özellikler sergiler ve yüksek elektrokimyasal potansiyeli nedeniyle pillerde yaygın olarak kullanılır.
| IUPAC Adı | Lityum oksit |
| Moleküler formül | Li2O |
| CAS numarası | 12142-77-7 |
| Eş anlamlı | Lityum(I) oksit; Dilityum oksit; Lithia; oksolityum; UNII-06T3K8P3KU |
| InChI | InChI=1S/2Li.O |
Lityum Oksit Formülü
Lityum Oksit Formülü
Dilityum oksidin kimyasal formülü Li2O’dur. İki lityum (Li) atomu ve bir oksijen (O) atomunun birleşimini temsil eder. Bu basit ve kararlı bileşik, çeşitli endüstriyel uygulamalarda gereklidir.
Lityum Oksit Molar Kütlesi
Li2O’nun molar kütlesi yaklaşık 29,88 g/mol’dür. İki lityum atomunun (her biri 6,94 g/mol) ve bir oksijen atomunun (16,00 g/mol) atomik kütlelerinin eklenmesiyle hesaplanır.
Lityum oksidin kaynama noktası
Dilityum oksit, yaklaşık 2.463 santigrat derece (4.465 Fahrenheit derece) civarında etkileyici bir kaynama noktasına sahiptir. Bu olağanüstü yüksek kaynama noktası, onu aşırı ısı direnci gerektiren endüstrilerde faydalı kılar.
Lityum Oksit Erime Noktası
Dilityum oksidin erime noktası yaklaşık 1.450 santigrat derecedir (2.642 Fahrenheit derece). Bu sıcaklığa maruz kaldığında katı halden sıvı hale geçerek çeşitli üretim süreçlerini kolaylaştırır.
Lityum oksit yoğunluğu g/mL
Dilityum oksitin yoğunluğu yaklaşık 2,01 g/mL’dir. Bu değer, bileşiğin birim hacim başına kütlesini temsil eder ve özelliklerini ve uygulamalarını belirlemek için gereklidir.
Lityum Oksit Molekül Ağırlığı
Li2O’nun moleküler ağırlığı 29,88 g/mol’dür. Bu, onu oluşturan elementlerin, lityum ve oksijenin atom ağırlıklarının toplamıdır. Bu değer stokiyometrik hesaplamaları kolaylaştırır.
Lityum oksidin yapısı
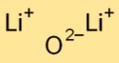
Dilithium oksit basit bir iyonik kristal yapıya sahiptir. Güçlü elektrostatik kuvvetlerle bir arada tutulan lityum katyonlarından (Li+) ve oksit anyonlarından (O2-) oluşur. Bu düzenleme stabilitesine ve iletkenliğine katkıda bulunur.
Lityum oksidin çözünürlüğü
Dilityum oksit suda düşük çözünürlüğe sahiptir. Su ile reaksiyona girerek lityum hidroksit oluşturur ve çözünmesini sınırlar. Bununla birlikte, bazı sulu olmayan çözücüler ve erimiş tuzlarda bir miktar çözünürlük sergiler.
Sonuç olarak dilityum oksit, çeşitli özellikleri ve uygulamaları olan önemli bir bileşiktir. Kararlı yapısı, yüksek erime ve kaynama noktaları onu seramik, cam imalatı gibi endüstrilerde ve özel pillerin bir bileşeni olarak değerli kılar. Özelliklerini anlamak, potansiyelinden çeşitli amaçlarla yararlanmamıza olanak tanır.
| Dış görünüş | Beyaz katı |
| Spesifik yer çekimi | 2,01g/ml |
| Renk | Beyaz |
| Koku | Kokusuz |
| Molar kütle | 29,88 gr/mol |
| Yoğunluk | 2,01g/ml |
| Füzyon noktası | 1.450°C (2.642°F) |
| Kaynama noktası | 2463°C (4465°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Suyla reaksiyona girer |
| çözünürlük | Suda zayıf çözünürlük, lityum hidroksit formu |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Parlama noktası, buhar basıncı, buhar yoğunluğu, pKa ve pH gibi bazı özelliklerin, kimyasal doğası ve davranışı nedeniyle Li2O için geçerli olmadığını veya mevcut olmadığını lütfen unutmayın.
Lityum Oksit Güvenliği ve Tehlikeleri
Dilityum oksit bazı güvenlik endişeleri ve tehlikeleri oluşturur. Suyla güçlü bir şekilde reaksiyona girerek yakıcı olan ve cilt ve göz tahrişine neden olabilen lityum hidroksit üretir. Tozunun veya dumanının solunması solunum yolu tahrişine neden olabilir. Bileşik yüksek düzeyde toksik olarak sınıflandırılmamıştır ancak cilt veya gözlerle temasını önlemek için dikkatle kullanılmalıdır. Dilityum oksitle çalışırken uygun havalandırma ve kişisel koruyucu ekipman şarttır. Kazara yutulması durumunda derhal tıbbi müdahale gereklidir. Ayrıca olası yangın veya patlama riskini önlemek için uyumsuz maddelerden uzakta saklanmalıdır.
| Tehlike sembolleri | Aşındırıcı |
| Güvenlik Açıklaması | Su ile reaksiyona girer. Cilt ve göz tahrişine neden olur. Dikkatli tutun. Toz veya dumanları solumaktan kaçının. |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2825.70.00 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | III |
| Toksisite | Çok zehirli değil ama dikkatli olunması gerekiyor. Yutmaktan ve cilt veya gözlerle temasından kaçının. |
Lityum Oksit Sentez Yöntemleri
Çeşitli yöntemler dilityum oksit sentezine izin verir.
Yaygın bir yaklaşım, lityum metalinin yüksek sıcaklıklarda oksijen veya hava ile reaksiyona sokulmasını içerir. Bu süreçte oksijen gazı lityum metalinin ısınmasını kolaylaştırarak dilityum oksit oluşumuna neden olur.
Başka bir yöntem, lityum karbonat veya lityum hidroksit gibi lityum tuzlarının yüksek sıcaklıklarda termal ayrışmasıdır. Bu tuzlar ısıya maruz bırakıldığında ayrışarak dilityum oksit üretirler.
Ayrıca dilityum oksit üretmek için lityum hidroksit öncü olarak kullanılabilir. İlk önce ısıtılarak dehidre edilir ve istenilen oksit formuna dönüştürülür.
Başka bir teknik, lityum içeren minerallerin veya cevherlerin kullanımını içerir. Kimyasal işlemler, bu doğal kaynaklardan lityum bileşiklerini çıkarır ve bunlar da dilityum oksit üretmek için daha ileri işlemlere tabi tutulur.
Her sentez yönteminin maliyet, verimlilik ve saflık açısından belirli avantajlara ve zorluklara sahip olabileceğini unutmamak önemlidir. Bilim adamları ve mühendisler, belirli endüstriyel veya araştırma gereksinimlerini karşılamak üzere dilityum oksit üretmek için en uygun yöntemi seçerken bu faktörleri göz önünde bulundururlar.
Lityum Oksit Kullanım Alanları
Dilityum oksit (Li2O), benzersiz özellikleri nedeniyle çeşitli endüstrilerde çok yönlü uygulamalar bulur. İşte bazı temel kullanımlar:
- Seramik endüstrisi: Dilityum oksit, seramiklerin önemli bir bileşenidir ve mekanik mukavemetlerini ve termal stabilitelerini artırır. Ayrıca pişirme sıcaklığını düşürerek üretim sürecinde enerji tasarrufu sağlar.
- Cam üretimi: Cam endüstrisinde, dilityum oksit bir akış görevi görerek camın erime sıcaklığını düşürür ve kimyasal saldırılara karşı direncini artırarak yüksek kaliteli cam ürünleri elde edilmesini sağlar.
- Pil teknolojisi: Dilityum oksit, lityum iyon pillerin üretiminde öncü görevi görür. Pilin katot malzemelerine katkıda bulunarak enerji depolama kapasitesini ve genel performansını artırır.
- Kurutucu: Dilityum oksidin suya olan güçlü afinitesi, onu klima ve gaz arıtma sistemleri gibi belirli ortamlardan nemi uzaklaştırmak için kullanılan etkili bir kurutucu yapar.
- Metalurji: Metalurjik işlemlerde dilityum oksit, yabancı maddeleri gidererek metallerin rafine edilmesine yardımcı olur.
- Özel Camlar: Optik, elektronik ve bilimsel aletler gibi çeşitli uygulamalara yönelik özel camların üretimi, dilityum oksit kullanımını içerir.
- Katalizör: Dilityum oksit, belirli kimyasal reaksiyonlarda katalizör görevi görerek reaktanların istenen ürünlere dönüşmesini kolaylaştırır.
- Nükleer endüstri: Nükleer endüstride dilityum oksit, nükleer fisyon reaksiyonlarının hızını kontrol eden bir nötron moderatörü olarak işlev görür.
Uygulama çeşitliliği, dilityum oksidin teknoloji, üretim ve bilimsel araştırmaların ilerlemesindeki önemini vurgulamaktadır. Eşsiz özellikleri, çeşitli endüstrilerde yenilikçiliği teşvik etmeye devam ediyor ve bu da onu geniş bir pratik kullanım yelpazesine sahip değerli bir bileşik haline getiriyor.
Sorular:
Soru: Hangi denklem lityum oksidin oksijen ve lityum arasındaki reaksiyondan oluştuğunu gösterir?
A: 4Li + O2 → 2Li2O
S: Lityum oksit, Li2O’nun molar kütlesi nedir?
A: Li2O’nun molar kütlesi yaklaşık 29,88 g/mol’dür.
S: Lityum oksidin formülü nedir?
C: Dilityum oksidin formülü Li2O’dur.
S: Lityum oksit iyonik mi yoksa kovalent mi?
C: Dilithium oksit iyoniktir.
S: İyonik bir bağdaki lityumun oksidasyon sayısı nedir?
C: İyonik bir bağdaki lityumun oksidasyon sayısı +1’dir.
S: Li2O’daki lityumun koordinasyon numarası?
C: Li2O’daki lityumun koordinasyon sayısı 4’tür.
S: Li2O iyonik mi yoksa kovalent mi?
C: Li2O iyoniktir.
S: Aşağıdaki reaksiyonlardan hangisi Li2O’nun kafes enerjisi (ΔH°latt) ile ilişkilidir?
A: Reaksiyon: Li+(g) + O2-(g) → Li2O(s)
S: Lityum oksit, Li2O’nun molar kütlesi nedir?
A: Li2O’nun molar kütlesi yaklaşık 29,88 g/mol’dür.
Soru: Lityum metalinin (Li) yakılması sırasında aşağıdakilerden hangisi ortaya çıkar? O2, LiO, H2O, Li2O?
C: Metalik lityumun (Li) yanması sırasında Li2O üretilecektir.
S: 4,5 mol Li2O’da kaç gram var?
C: 4,5 mol Li2O’da yaklaşık 134,46 gram bulunur.
