Altın oksit (Au2O3), altın ve oksijenden oluşan bir bileşiktir. Metalik altından farklı özellikler sergilemesi onu çeşitli bilimsel ve endüstriyel uygulamalarda ilgi çekici kılmaktadır.
| IUPAC Adı | Altın(III) oksit |
| Moleküler formül | Au2O3 |
| CAS numarası | 1303-58-8 |
| Eş anlamlı | Aurik oksit, altın seskioksit, altın trioksit, digold trioksit |
| InChI | InChI=1S/2Au.3O |
Altın (III) oksidin özellikleri
Altın Oksit Formülü
Altın trioksitin formülü Au2O3’tür. İki altın atomu ve üç oksijen atomundan oluşur. Bu kimyasal formül, bileşikteki elementlerin oranını gösterir.
Altın Oksit Molar Kütlesi
Altın trioksitin (Au2O3) molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Altının (Au) molar kütlesi 196,97 g/mol ve oksijenin (O) molar kütlesi 16,00 g/mol’dür. Yani Au2O3’ün molar kütlesi yaklaşık 441,97 g/mol’dür.
Altın oksidin kaynama noktası
Altın trioksit kaynama noktasına ulaşmadan önce bozunmaya uğradığı için belirgin bir kaynama noktasına sahip değildir. Isıtıldığında kendisini oluşturan elementlere ayrılır.
Altın oksidin erime noktası
Altın trioksitin erime noktası yaklaşık 1.600 °C’dir (2.912 °F). Bu sıcaklıkta katı altın trioksit sıvı hale geçerek yüksek sıcaklık proseslerinde çeşitli uygulamaları kolaylaştırır.
Altın oksit yoğunluğu g/mL
Altın trioksitin yoğunluğu yaklaşık 11,34 g/mL’dir. Bu değer birim hacim başına düşen kütlesini gösterir ve diğer birçok malzemeye göre yoğunluğunun yüksek olduğunu gösterir.
Altın oksidin moleküler ağırlığı
Altın trioksitin (Au2O3) moleküler ağırlığı yaklaşık 441,97 g/mol’dür. Bu değer, bileşiğin bir molekülündeki tüm atomların atom ağırlıklarının toplamını temsil eder.
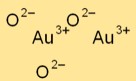
Altın oksidin yapısı
Altın trioksit (Au2O3) karmaşık bir kristal yapıya sahiptir. Kristal kafes içinde belirli desenler oluşturan altın ve oksijen atomlarından oluşan eşkenar dörtgen bir kafes düzenlemesine sahiptir.
Altın oksidin çözünürlüğü
Altın trioksit (Au2O3) genellikle suda ve çoğu organik çözücüde çözünmez. Düşük çözünürlük gösterir, bu da yalnızca eser miktarların çözündüğü anlamına gelir, bu da sulu çözeltilerde genellikle düşük reaktiviteye yol açar.
| Dış görünüş | Sağlam |
| Spesifik yer çekimi | Yok |
| Renk | Siyah veya kahverengimsi siyah |
| Koku | Kokusuz |
| Molar kütle | 441,97 gr/mol |
| Yoğunluk | 11.34 gr/ml |
| Füzyon noktası | 1600°C (2912°F) |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Yok |
| sudaki çözünürlük | Çözünmez |
| çözünürlük | sulu çözeltilerde düşük reaktivite |
| Buhar basıncı | Yok |
| Buhar yoğunluğu | Yok |
| pKa | Yok |
| pH | Yok |
Altın Oksit Güvenliği ve Tehlikeleri
Altın trioksit çeşitli güvenlik ve tehlike hususlarını gündeme getirmektedir. Cilt, göz veya solunum sistemi ile teması halinde tahriş edici olabilir. Kullanım sırasında eldiven ve gözlük gibi uygun koruyucu ekipmanlar kullanılmalıdır. Ayrıca altın trioksit, sağlık açısından olumsuz etkilere neden olabileceğinden yutulması veya solunması uygun değildir. Bu bileşikle çalışırken, tozuna veya dumanına maruz kalma riskini en aza indirmek için iyi havalandırma sağlayın. Ayrıca, kazara yutulması veya maruz kalınması durumunda derhal tıbbi yardım isteyin. Altın trioksitin laboratuvar ve endüstriyel ortamlarda güvenli kullanımını sağlamak için uygun depolama ve taşıma uygulamaları önemlidir.
| Tehlike sembolleri | Tahriş edici |
| Güvenlik Açıklaması | Tahriş edici, Teneffüs etmekten kaçının, Ciltte aşınma, Ciddi göz hasarı |
| BM kimlik numaraları | Yok |
| HS kodu | Yok |
| Tehlike sınıfı | Yok |
| Paketleme grubu | Yok |
| Toksisite | Zayıf |
BM tanımlayıcıları, HS kodu, tehlike sınıfı ve paketleme grubu gibi bazı özelliklerin altın oksit için geçerli olmayabileceğini veya iyi tanımlanmayabileceğini lütfen unutmayın.
Altın Oksit Sentez Yöntemleri
Çeşitli yöntemler altın trioksitin sentezine izin verir.
Yaygın bir yaklaşım, metalik altının yüksek sıcaklıklarda ozon gazı ile reaksiyonunu içerir. Bu işlem sırasında altın ozonla reaksiyona girerek altın trioksit oluşturur. Başka bir yöntem, altın nitrat veya altın hidroksit gibi altın tuzlarının termal ayrışmasını içerir. Isıtıldığında bu bileşikler ayrışır ve ürünlerden biri olarak altın trioksit üretir.
Altın trioksit çökeltme yoluyla hazırlanabilir. Bu, bir altın tuzu çözeltisinin, alkali metal hidroksit NaOH gibi uygun bir çökeltici maddeyle karıştırılmasını içerir. Daha sonra elde edilen çökeltinin daha fazla işlenmesiyle saf altın trioksit elde edilir.
Ek olarak, altın içeren bir elektrolitin elektrolizi, anot yüzeyinde altın trioksit oluşumuna yol açabilir. Bu yöntem özellikle ince altın trioksit filmlerinin üretilmesi için kullanışlıdır.
Araştırmacılar istenen saflık, parçacık boyutu ve altın trioksit uygulaması gibi faktörlere dayalı olarak özel bir sentez yöntemi seçebilirler. Spesifik kullanımlar için optimum özelliklere sahip istenen ürünü elde etmek için reaksiyon koşullarının dikkatli kontrolü önemlidir.
Altın Oksit Kullanım Alanları
Altın trioksit benzersiz özelliklerinden dolayı çeşitli uygulamalar bulur. İşte kullanımları:
- Kataliz: Altın trioksit, karbon monoksit ve diğer hidrokarbonların oksidasyonu da dahil olmak üzere belirli kimyasal reaksiyonlarda katalizör görevi görür. Katalitik verimliliği nedeniyle endüstriyel proseslerde değerlidir.
- Cam Renklendirme: Altın trioksit, cama karakteristik bir kırmızı renk vererek onu dekoratif amaçlar ve vitray sanatı yaratmak için kullanışlı hale getirir.
- Araştırma: Bilim adamları, kataliz araştırması, malzeme bilimi ve nanoteknoloji dahil olmak üzere çeşitli araştırma çalışmalarında altın trioksit kullanıyor.
- Fotokataliz: Altın trioksit fotokatalitik özellikler sergileyerek ışığa maruz kaldığında su ve havadaki organik kirleticilerin parçalanmasını sağlar.
- Yakıt Hücreleri: Altın trioksit, yakıt hücrelerinde katalizör görevi görerek elektrokimyasal reaksiyonları artırır ve verimliliklerini artırır.
- Kimyasal sentez: Altın trioksit, çeşitli alanlarda uygulama alanı bulan altın nanopartikülleri gibi diğer altın bileşiklerinin sentezini kolaylaştırır.
- Tıp: Araştırmacılar, kanser tedavisi ve antimikrobiyal özellikleri de dahil olmak üzere altın trioksitin potansiyel tıbbi uygulamalarını araştırdılar.
- Sensör Teknolojisi: Üreticiler, gaz algılama cihazlarında, çevresel izlemede ve tehlikeli madde tespitinde altın trioksit sensörlerini kullanır.
- Elektronik: Üreticiler, yüksek erime noktası ve kararlılığı nedeniyle elektronikte, örneğin yarı iletkenlerin ve dirençlerin üretiminde ince altın trioksit filmleri kullanır.
- Nanoteknoloji: Nanoteknolojide araştırmacılar, biyouyumlulukları sayesinde altın trioksit nanopartiküllerini ilaç dağıtım sistemleri ve tıbbi teşhis için umut verici malzemeler olarak kullanıyorlar.
Bu uygulamalar, altın trioksitin çeşitli endüstrilerdeki çok yönlülüğünü ve önemini ortaya koyarak teknoloji, bilim ve sağlık alanındaki gelişmelere katkıda bulunmaktadır.
Sorular:
S: Au2O3’teki Au’nun oksidasyon sayısı nedir?
C: Au2O3’teki Au’nun oksidasyon sayısı +3’tür.
S: 212 gram Au2O3’ün reaksiyonundan STP’de ne kadar O2 üretilir?
C: 212 gram Au2O3’ün reaksiyonundan STP’de yaklaşık 160,7 litre O2 üretilecektir.
S: Au2O3 ne için kullanılır?
C: Au2O3’ün elektronik, nanoteknoloji, cam renklendirme ve araştırma çalışmalarında katalizör olarak uygulamaları vardır.
S: Bir metrik ton (1000 kg) Au2O3’te kaç gram altın olacaktır?
C: Bir metrik ton (1000 kg) Au2O3’te yaklaşık 432,09 gram altın olacaktır.
Soru: Bir ton Au2O3’te kaç gram altın olacak?
C: Bir ton Au2O3’te yaklaşık 432.090 gram altın bulunacaktır.
S: Altın(III) oksit iyonik mi yoksa moleküler mi?
C: Altın(III) oksit (Au2O3) iyonik bir bileşiktir.
S: Altın(III) oksit ne için kullanılır?
C: Altın(III) oksit katalizde, elektronikte, nanoteknolojide, cam renklendirmede ve yakıt hücresi uygulamalarında kullanılır.
S: Altın(III) oksidin kimyasal formülü nedir?
C: Altın(III) oksidin kimyasal formülü Au2O3’tür.
