Bor tribromür (BBr3), çeşitli reaksiyonlarda katalizör olarak kullanılan kimyasal bir bileşiktir. Bir bor atomu ve üç brom atomundan oluşur.
| IUPAC Adı | Bor tribromür |
| Moleküler formül | BBr3 |
| CAS numarası | 10294-33-4 |
| Eş anlamlı | Tribromoboran; Bor bromür; Bor(III) bromür; Bromobor; Bor tribromür, [B(Br)3]; Tribromo-boran |
| InChI | InChI=1S/3BrH.B/h3*1H;/q;;;+3/p-3 |
Bor tribromürün özellikleri
Bor Tribromür Formülü
Bor bromürün formülü BBr3’tür. Bir bor atomu ve üç brom atomundan oluşur. Bu kimyasal bileşik bor ve bromun birleşiminden oluşur.
Bor Tribromid Molar Kütlesi
Bor bromürün molar kütlesi (BBr3), bor ve üç brom atomunun atomik kütleleri toplanarak hesaplanabilir. Borun atom kütlesi mol başına yaklaşık 10,81 gramdır ve bromun atom kütlesi mol başına yaklaşık 79,90 gramdır. Yani BBr3’ün molar kütlesi mol başına yaklaşık 250,60 gramdır.
Bor tribromürün kaynama noktası
Bor bromür nispeten düşük bir kaynama noktasına sahiptir. Yaklaşık 91 santigrat derecede (196 Fahrenheit derece) kaynamaya başlar. Bu sıcaklıkta bileşik, BBr3 buharlarını açığa çıkararak sıvıdan gaza faz değişimine uğrar.
Bor tribromür Erime noktası
Bor bromürün erime noktası nispeten yüksektir. -46 santigrat derece (-51 Fahrenheit derece) civarında erimeye başlar. Bu sıcaklıkta katı bileşik sıvı duruma dönüşür.
Bor tribromürün yoğunluğu g/mL
Bor bromürün yoğunluğu mililitre başına yaklaşık 2,63 gramdır (g/mL). Bu yoğunluk, bileşiğin bir mililitresinde bulunan BBr3’ün kütlesini gösterir. Maddenin kompaktlığının veya konsantrasyonunun bir ölçüsüdür.
Bor Tribromür Molekül Ağırlığı
Bor bromürün (BBr3) moleküler ağırlığı, borun atomik kütleleri ve üç brom atomunun eklenmesiyle hesaplanır. BBr3’ün moleküler ağırlığı mol başına yaklaşık 250.60 gramdır.
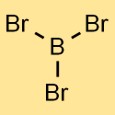
Bor tribromürün yapısı
Bor bromürün yapısı, üç brom atomuna bağlı bir bor atomundan oluşur. Düzenleme, bor atomunun merkezde olduğu ve üç brom atomunun etrafına eşit şekilde dağıldığı trigonal düzlemsel bir geometri oluşturur.
Bor tribromürün çözünürlüğü
Bor bromür çok reaktif bir bileşiktir ve genellikle suda az çözünür. Hidrobromik asit ve borik asit oluşturmak için suyla reaksiyona girme eğilimindedir. Bununla birlikte BBr3, kloroform, karbon tetraklorür ve karbon disülfür gibi organik çözücülerde çözünür.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 2.63g/ml |
| Renk | Renksiz |
| Koku | Dönüm |
| Molar kütle | 250,60 gr/mol |
| Yoğunluk | 2.63g/ml |
| Füzyon noktası | -46°C |
| Kaynama noktası | 91°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Tepki verir |
| çözünürlük | Kloroform, CCl4 ve karbon disülfür gibi organik çözücülerde çözünür |
| Buhar basıncı | 78 mmHg |
| Buhar yoğunluğu | 6,52 (hava=1) |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Bor tribromürün güvenliği ve tehlikeleri
Bor bromür bazı güvenlik riskleri teşkil etmektedir ve bu bileşik kullanılırken dikkatli olunmalıdır. Cilt, gözler ve solunum sistemi için aşındırıcıdır. Doğrudan temas yanıklara ve ciddi tahrişe neden olabilir. Buharlarının solunması solunum rahatsızlığına neden olabilir. Suyla kuvvetli reaksiyona girerek zehirli dumanlar yayar. Bu nedenle iyi havalandırılan bir alanda kullanılmalı ve eldiven, gözlük gibi uygun kişisel koruyucu ekipmanlar kullanılmalıdır. Nemden ve uyumsuz maddelerden uzakta saklanmalıdır. Maruz kalınması halinde derhal tıbbi müdahale gereklidir. Bor bromür ile ilişkili riskleri en aza indirmek için uygun güvenlik protokolleri ve yönergeleri takip edilmelidir.
| Tehlike sembolleri | Aşındırıcı, ıslandığında tehlikeli |
| Güvenlik Açıklaması | Cilt, göz ve giysilerle temasından kaçının. İyi havalandırılan bir ortamda kullanınız. Eldiven ve koruyucu gözlük takın. |
| BM kimlik numaraları | UN3264 |
| HS kodu | 2811.19.9000 |
| Tehlike sınıfı | 8 |
| Paketleme grubu | II |
| Toksisite | Solunması ve yutulması halinde toksiktir; ciddi cilt yanıklarına ve göz hasarına neden olur. |
Bor tribromürün sentezi için yöntemler
Bor bromür çeşitli yöntemlerle sentezlenebilir. Yaygın bir yöntem, bor oksit (B2O3) ile bromin (Br2) arasındaki reaksiyonu içerir. Reaksiyon, karbon veya alüminyum gibi bir katalizörün varlığında yüksek sıcaklıklarda gerçekleşir. Ortaya çıkan reaksiyon bor bromür üretir ve oksijen gazını açığa çıkarır.
Başka bir yöntem bor triklorür (BCl3) ile bromin arasındaki reaksiyonu içerir. Bu reaksiyon oda sıcaklığında meydana gelir ve yan ürünler olarak bor bromür ve klor gazı oluşturur.
Bor bromür hazırlamak için bor, kontrollü bir ortamda aşırı brom ile reaksiyona sokulabilir; bu, yüksek sıcaklıklar ve reaksiyon koşullarının dikkatli bir şekilde kontrol edilmesini gerektirir.
Diğer bir yöntem, diboran (B2H6) veya boran (BH3) gibi bor hidritlerinin hidrojen bromür (HBr) ile reaksiyona sokulması yoluyla bor bromürün sentezlenmesidir. Bu reaksiyon ürün olarak bor bromür ve hidrojen gazı üretir.
Bor bromürün oldukça reaktif yapısı nedeniyle bu sentez yöntemlerinin dikkatli olması gerektiğini unutmayın. Sentez işlemi sırasında uygun koruyucu ekipman giymek ve iyi havalandırılan bir alanda çalışmak gibi uygun güvenlik protokollerine uyulmalıdır.
Bor tribromürün kullanım alanları
Bor bromürün (BBr3) çeşitli endüstrilerde birçok önemli kullanımı vardır. İşte bazı önemli uygulamalar:
- Katalizör: BBr3, organik sentez reaksiyonlarını aktif olarak katalize ederek asilasyon, alkilasyon ve halojenasyon reaksiyonları gibi süreçleri mümkün kılar.
- Kimyasal ara maddeler: BBr3, bor içeren reaktifleri, boronik asitleri ve bor bazlı polimerleri sentezleyerek diğer bor bileşiklerinin üretiminde bir öncü görevi görür.
- Polimerizasyon: BBr3, bir Lewis asidi katalizörü olarak görev yaparak, özellikle polietilen ve polipropilen gibi polimerlerin üretiminde polimerizasyon reaksiyonlarına aktif olarak katılır.
- Doping ajanı: Yarı iletken endüstrisi, silikonun elektriksel özelliklerini elektronik cihazlara uygunluk açısından değiştiren bir doping ajanı olarak BBr3’ü aktif olarak kullanır.
- Gaz algılama: BBr3, amonyak gibi belirli gazlarla aktif olarak reaksiyona girerek, onu algılama ve izleme amacıyla kullanılan gaz dedektörleri ve sensörler için uygun hale getirir.
- Laboratuvar Reaktifi: BBr3, çeşitli laboratuvar deneylerinde ve araştırmalarında aktif olarak bir reaktif olarak görev yapar, brominasyon reaksiyonlarını gerçekleştirir ve sentetik kimyada brom atomlarının kaynağı olarak görev yapar.
- Farmasötik sentez: İlaç endüstrisi, belirli ilaçların ve farmasötik ara maddelerin sentezinde BBr3’ü aktif olarak kullanır.
Aşındırıcı ve reaktif yapısı nedeniyle bor bromürün uygun güvenlik protokollerini takip ederek dikkatli bir şekilde işlenmesi önemlidir.
Sorular:
S: Bor tribromürün (BBr3) reaktivitesini hangi terim tanımlar?
C: Çok duyarlı.
S: Bor tribromürün formülü nedir?
C: Bor bromürün formülü BBr3’tür.
Soru: 3,24 gram bor tribromürde kaç tane bor atomu vardır?
C: 3,24 gramda 0,053 mol BBr3 vardır, bu da 0,159 mol bor veya yaklaşık 9,62 x 10^22 atoma karşılık gelir.
Soru: 3,49 gram bromdan kaç gram bor tribromür üretilebilir?
A: BBr3’ün molar kütlesi 250,60 g/mol’dür. Yani yaklaşık 3,49 gram brom, yaklaşık 3,34 gram bor bromür üretebilir.
Soru: BBr3 formülüne sahip bileşiğin adı nedir?
C: BBr3 formülüne sahip bileşiğe boron bromür denir.
S: Bor tribromür polar mı yoksa polar değil mi?
C: Bor bromür polar bir bileşiktir.
S: BBr3’ün elektronik geometrisi nedir?
C: BBr3’ün elektronik geometrisi düzlemsel üçgendir.
S: BBr3 için Lewis yapısı nedir?
A: BBr3’ün Lewis yapısında merkezde üç brom atomu ile çevrelenmiş bir bor atomu bulunmaktadır.
S: BBr3’te kaç tepe noktası var?
C: Bor bromür (BBr3), NMR spektrumunda bir zirveye sahiptir.
