Nikel hidroksit (Ni(OH)2), nikel ve hidroksit iyonlarından oluşan kimyasal bir bileşiktir. Genellikle nikel bazlı pillerin öncüsü olarak kullanılır.
| IUPAC’ın adı | Nikel hidroksit |
| Moleküler formül | Ni(OH)2 |
| CAS numarası | 12054-48-7 |
| Eş anlamlı | Nikel(II) hidroksit; Nikel hidroksit; Azot Nikel Trioksit (2+) |
| InChI | InChI=1S/Ni.2H2O/h;2*1H2/q+2;;/p-2 |
Nikel hidroksitin özellikleri
Nikel Hidroksit Formülü
Nikel hidroksitin formülü Ni(OH)2’dir. Bir nikel iyonu (Ni) ve iki hidroksit iyonundan (OH-) oluşur. Bu kimyasal formül, nikel hidroksitin atomik seviyedeki bileşimini temsil eder.
Nikel Hidroksit Molar Kütlesi
Ni(OH)2’nin molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanır. Nikelin atom kütlesi 58,6934 g/mol ve her bir hidroksit iyonunun kütlesi 17,007 g/mol’dür. Bunları topladığımızda Ni(OH)2’nin molar kütlesi yaklaşık 92,6934 g/mol olur.
Nikel hidroksitin kaynama noktası
Ni(OH)2’nin iyi tanımlanmış bir kaynama noktası yoktur çünkü ısıtıldığında ayrışır. Yüksek sıcaklıklarda termal ayrışmaya uğrar ve nikel oksit (NiO) ve su buharına dönüşür.
Nikel hidroksitin erime noktası
Ni(OH)2’nin erime noktası yaklaşık 230°C’dir. Bu sıcaklıkta Ni(OH)2 katı halden sıvı hale faz değişimine uğrar. Bileşik eriyerek daha fazla kimyasal reaksiyona veya işleme olanak sağlar.
Nikel hidroksitin yoğunluğu g/mL
Ni(OH)2’nin yoğunluğu yaklaşık 4,1 g/mL’dir. Bu değer, bileşiğin birim hacim başına kütlesini temsil eder. Belirli bir alandaki Ni(OH)2’nin kompaktlığını veya konsantrasyonunu gösterir.
Nikel Hidroksit Molekül Ağırlığı
Ni(OH)2’nin moleküler ağırlığı, onu oluşturan elementlerin atom ağırlıklarının eklenmesiyle belirlenir. Nikel 58.6934 g/mol atom ağırlığına sahiptir ve her bir hidroksit iyonu 17.007 g/mol ağırlığındadır. Dolayısıyla Ni(OH)2’nin molekül ağırlığı yaklaşık 92,6934 g/mol’dür.
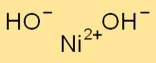
Nikel hidroksitin yapısı
Ni(OH)2 altıgen kristal sistemde kristalleşir. Üst üste istiflenmiş Ni+2 ve OH- iyonlarından oluşan katmanlar oluşturur. Ni+2 iyonları OH- iyonları ile koordineli bir şekilde çevrelenerek bir ağ yapısı oluşturulur.
Nikel hidroksitin çözünürlüğü
Ni(OH)2 suda çok az çözünür. Hidroksit iyonlarının varlığı nedeniyle hafif alkali bir çözelti oluşturarak bir dereceye kadar çözünür. Ni(OH)2’nin çözünürlüğü sıcaklık ve pH gibi faktörlerden etkilenebilir.
| Dış görünüş | Koyu yeşil |
| Spesifik yer çekimi | 4.1g/ml |
| Renk | Yeşil |
| Koku | Kokusuz |
| Molar kütle | 92,6934 gr/mol |
| Yoğunluk | 4.1g/ml |
| Füzyon noktası | 230°C |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Yok |
| sudaki çözünürlük | Az çözünür |
| çözünürlük | Çözünmez, suda alkali bir çözelti oluşturur |
| Buhar basıncı | Yok |
| Buhar yoğunluğu | Yok |
| pKa | Yok |
| pH | Alkali |
Nikel Hidroksitin Güvenliği ve Tehlikeleri
Ni(OH)2 dikkate alınması gereken bazı güvenlik riskleri taşır. Temas veya solunması halinde cildi, gözleri ve solunum sistemini tahriş edebilir. Uzun süreli veya tekrarlanan maruz kalma, duyarlılığa yol açarak alerjik reaksiyonlara neden olabilir. Ni(OH)2’yi eldiven, gözlük ve solunum cihazı gibi uygun koruyucu önlemler kullanarak dikkatli bir şekilde kullanmak önemlidir. Yutma veya kazara maruz kalma durumunda derhal tıbbi yardıma başvurulmalıdır. Ayrıca Ni(OH)2 çevresel bir tehlike olarak kabul edilir ve toprağın veya su kaynaklarının kirlenmesini önlemek için yönetmeliklere uygun şekilde imha edilmesi gerekir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | – Cilt ve göz tahrişine neden olabilir\n- Solunum yolu tahrişine neden olabilir\n- Hassasiyet mümkündür\n- Uygun taşıma ve imha prosedürlerini izleyin |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2825.70.10 |
| Tehlike sınıfı | Tehlikeli olarak sınıflandırılmadı |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük ila orta derecede toksisite olarak kabul edilir |
Tehlikeli madde olarak sınıflandırılmadığı için tehlike sembollerinin ve BM tanımlayıcılarının Ni(OH)2 için geçerli olmadığını lütfen unutmayın. Sağlanan güvenlik tanımı, Ni(OH)2’nin kullanılmasıyla ilişkili potansiyel riskleri ve önlemleri vurgulamaktadır. Ni(OH)2’nin toksisitesinin genellikle düşük ila orta düzeyde olduğu kabul edilir.
Nikel hidroksit sentez yöntemleri
Ni(OH)2 üretimi için çeşitli sentetik yöntemler mevcuttur. Yaygın bir yöntem, nikel sülfat veya nikel nitrat gibi çözünür bir nikel tuzu ile bir alkalin hidroksit, genellikle sodyum hidroksit veya potasyum hidroksit arasındaki reaksiyonu içerir. Reaksiyon kontrollü koşullar altında sulu bir çözelti içinde gerçekleşir ve çökelti olarak Ni(OH)2 oluşumuyla sonuçlanır.
Elektrokimyasal biriktirme yönteminde, elektrolitik hücre elektrot olarak metalik nikeli kullanır. Elektrolitteki nikel iyonlarını indirgemek ve bunları Ni(OH)2 formunda elektrot üzerinde biriktirmek için uygun bir elektrik akımı uygular. Bu yöntem, elde edilen Ni(OH)2’nin bileşiminin ve morfolojisinin hassas kontrolüne olanak tanır.
Nikel tuzlarının termal ayrışması Ni(OH)2 üretimine olanak sağlar. Nikel karbonat veya Ni(OH)2 gibi bir nikel tuzunun kontrollü bir ortamda ısıtılmasıyla bileşik ayrışmaya uğrar ve Ni(OH)2’nin yanı sıra diğer yan ürünleri üretir.
Sentez yöntemi seçiminin istenen saflık, parçacık boyutu ve özel uygulama gereksinimleri gibi faktörlere bağlı olduğunu belirtmekte fayda var. Ni(OH)2 üretimi için uygun sentetik yol seçilirken, her yöntemin avantajları ve sınırlamaları nedeniyle istenen sonuç dikkatle değerlendirilmelidir.
Nikel Hidroksit Kullanım Alanları
Ni(OH)2 benzersiz özelliklerinden dolayı çeşitli uygulamalara sahiptir. Ni(OH)2’nin bazı yaygın kullanımları şunlardır:
- Pil üretimi: Ni(OH)2, nikel-kadmiyum (NiCd) ve nikel-metal hidrit (NiMH) piller gibi nikel bazlı pillerde katot malzemesi olarak çok önemli bir rol oynar. Elektrik enerjisini depolayıp serbest bırakarak verimli enerji depolamasına olanak tanır.
- Katalizör: Ni(OH)2, hidrojenasyon ve oksidasyon işlemleri de dahil olmak üzere çeşitli kimyasal reaksiyonlarda katalizör görevi görür. Katalitik özellikleri, reaktanların istenen ürünlere verimli bir şekilde dönüştürülmesini kolaylaştırır.
- Elektrokaplama: Ni(OH)2 stabil, yapışkan bir nikel tabakası oluşturur ve bu da onu elektrokaplama uygulamalarında değerli kılar. Çeşitli metal yüzeyler üzerinde koruyucu, korozyona dayanıklı ve estetik açıdan çekici bir kaplama sağlar.
- Pigmentler: Üreticiler Ni(OH)2’yi seramik, cam ve plastik üretiminde yeşil pigment olarak kullanırlar. Canlı yeşil rengi bu malzemelerin estetik değerini artırır.
- Gaz sensörleri: Ni(OH)2 bazlı sensörler hidrojen, amonyak ve hidrojen sülfür gibi gazları algılar ve izler. Ni(OH)2 filmlerindeki elektriksel iletkenlikteki değişiklikler bu gazların etkin bir şekilde tespit edilmesini sağlar.
- Su Arıtma: Ni(OH)2, kurşun ve kadmiyum gibi ağır metal kirleticileri seçici olarak adsorbe ederek ve ortadan kaldırarak su arıtma işlemlerine yardımcı olur. Bu metallere karşı bir afinite sergileyerek bunların su kaynaklarından uzaklaştırılmasında faydalı olmasını sağlar.
- Farmasötik uygulamalar: Ni(OH)2, tablet veya kapsül formülasyonlarında bağlayıcı, parçalayıcı veya pH düzenleyici olarak görev yaparak farmasötik formülasyonlarda uygulama alanı bulur.
Bunlar Ni(OH)2’nin çeşitli uygulamalarından sadece birkaç örnek olup, onun çeşitli endüstrilerdeki çok yönlülüğünü ve önemini göstermektedir.
Sorular:
S: Temel nikel(II) hidroksitin kimyasal formülü nedir?
C: Nikel(II) hidroksitin kimyasal formülü Ni(OH)2’dir.
S: Nikel hidroksit suda çözünür mü?
C: Ni(OH)2 suda çözünmez.
Soru: 75,0 ml 0,555 M lityum hidroksiti nötralize etmek için kaç gram nikel(II) klorüre ihtiyaç vardır?
C: Gerekli nikel klorür gramı, lityum hidroksit çözeltisinin stokiyometrisi ve molaritesi kullanılarak hesaplanabilir.
S: Ni(OH)2 hangi yükü temsil eder?
C: Ni(OH)2’nin yükü nötr veya sıfırdır.
S: Ni(OH)2’nin molar çözünürlüğü nasıl hesaplanır?
C: Ni(OH)2’nin molar çözünürlüğü, çözünen bileşiğin mol sayısının çözeltinin hacmine bölünmesiyle belirlenebilir.
S: NaOH(aq) + NiCl2(aq) → NaCl(aq) + Ni(OH)2(s) denkleminin dengeli formu nedir?
C: Dengeli denklem 2NaOH(aq) + NiCl2(aq) → 2NaCl(aq) + Ni(OH)2(s)’dir.
Soru: Ni(OH)2 mol başına kaç gramdır?
A: Ni(OH)2’nin molar kütlesi yaklaşık 92,6934 g/mol’dür.
S: Ni(OH)2 suda çözünür mü?
C: Hayır, Ni(OH)2 suda çözünmez.
S: Reaksiyondaki indirgeyici madde nedir: Mg + NiO2 + 2H2O → Mg(OH)2 + Ni(OH)2?
A: Reaksiyondaki indirgeyici madde magnezyumdur (Mg).
S: Ni(OH)2 katı mıdır?
C: Evet, Ni(OH)2 katı bir bileşiktir.
Soru: Eğer hücrenin 25°C’de 0,247 V potansiyeli varsa, Ni(OH)2’nin Ksp’si nedir?
C: Ni(OH)2’nin Ksp’si Nernst denklemi ve hücre potansiyeli kullanılarak belirlenebilir.
Soru: Hangi tuzlar asidik bir çözeltide saf suya göre daha fazla çözünür?
C: Ni(OH)2 gibi tuzlar, asitle nötralizasyon reaksiyonu nedeniyle asidik bir çözeltide daha fazla çözünür olacaktır.
