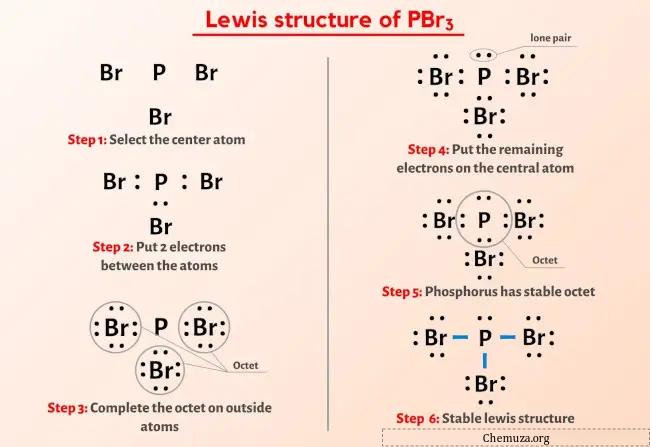
Yukarıdaki görseli zaten gördünüz değil mi?
Yukarıdaki görseli kısaca açıklayayım.
PBr3 Lewis yapısının merkezinde üç bromin (Br) atomu ile çevrelenmiş bir fosfor (P) atomu bulunur. Fosfor (P) atomu ile her bir bromin (Br) atomu arasında 3 adet tekli bağ vardır. Fosfor (P) atomunda 1 yalnız çift, üç brom (Br) atomunda ise 3 yalnız çift bulunur.
PBr3’ün Lewis yapısının yukarıdaki görüntüsünden hiçbir şey anlamadıysanız, benimle kalın ve PBr3’ün Lewis yapısının çizilmesine ilişkin ayrıntılı adım adım açıklamayı alacaksınız.
O halde PBr3’ün Lewis yapısını çizme adımlarına geçelim.
PBr3 Lewis Yapısını Çizim Adımları
Adım 1: PBr3 molekülündeki toplam değerlik elektronu sayısını bulun
Bir PBr3 molekülündeki değerlik elektronlarının toplam sayısını bulmak için öncelikle brom atomunun yanı sıra fosfor atomunda bulunan değerlik elektronlarını bilmeniz gerekir.
(Değerlik elektronları herhangi bir atomun en dış yörüngesinde bulunan elektronlardır.)
Burada size periyodik tabloyu kullanarak bromun yanı sıra fosforun değerlik elektronlarını nasıl kolayca bulacağınızı anlatacağım.
PBr3 molekülündeki toplam değerlik elektronları
→ Fosfor atomunun verdiği değerlik elektronları:
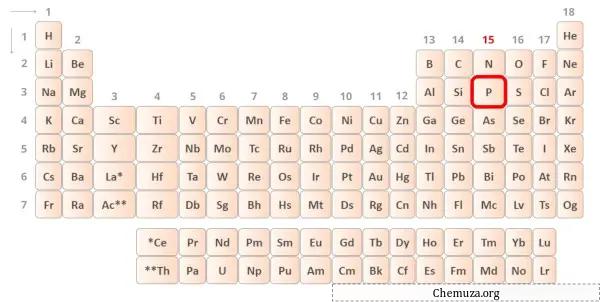
Fosfor periyodik tablonun 15. grubunda yer alan bir elementtir. [1] Bu nedenle fosforda bulunan değerlik elektronları 5’tir .

Yukarıdaki resimde gösterildiği gibi fosfor atomunda bulunan 5 değerlik elektronunu görebilirsiniz.
→ Brom atomunun verdiği değerlik elektronları:
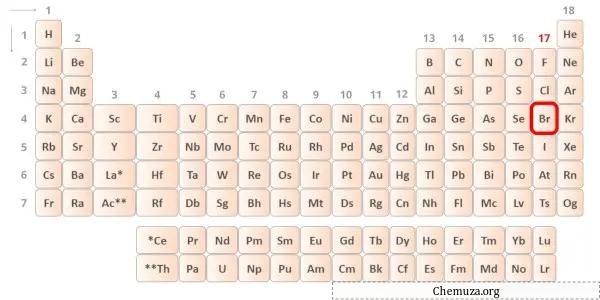
Brom, periyodik tablonun 17. grubunda yer alan bir elementtir. [2] Bu nedenle bromda bulunan değerlik elektronları 7’dir .
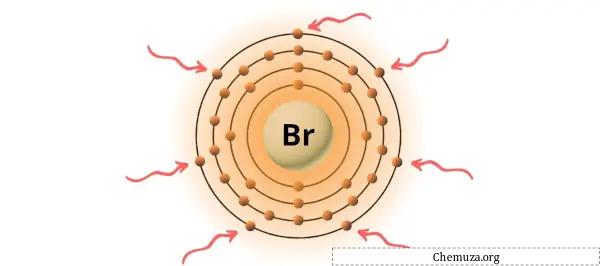
Yukarıdaki resimde gösterildiği gibi brom atomunda bulunan 7 değerlik elektronunu görebilirsiniz.
Bu yüzden,
PBr3 molekülündeki toplam değerlik elektronları = 1 fosfor atomu tarafından bağışlanan değerlik elektronları + 3 brom atomu tarafından bağışlanan değerlik elektronları = 5 + 7(3) = 26 .
Adım 2: Merkez atomu seçin
Merkez atomu seçmek için en az elektronegatif atomun merkezde kaldığını unutmamalıyız.
Şimdi burada verilen molekül PBr3’tür (fosfor tribromür) ve fosfor (P) atomları ve bromin (Br) atomları içerir.
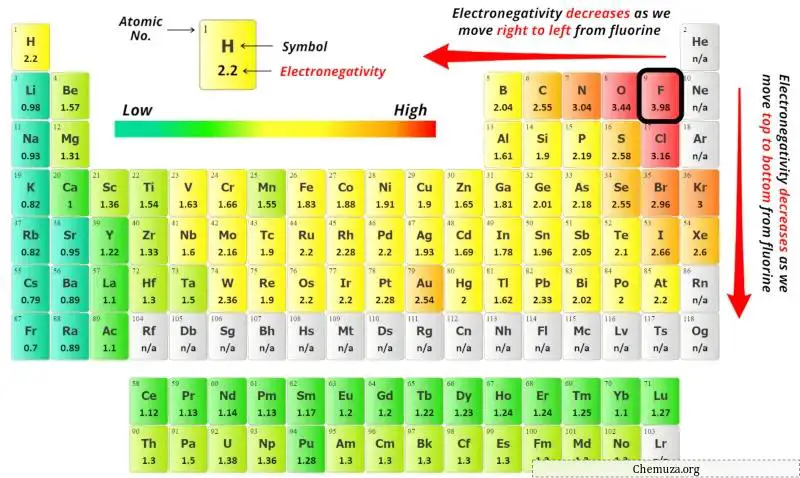
Yukarıdaki periyodik tabloda fosfor atomu (P) ve brom atomunun (Br) elektronegatiflik değerlerini görebilirsiniz.
Fosfor (P) ve bromun (Br) elektronegatiflik değerlerini karşılaştırırsak fosfor atomu daha az elektronegatiftir .
Burada fosfor (P) atomu merkez atom, brom (Br) atomları ise dış atomlardır.
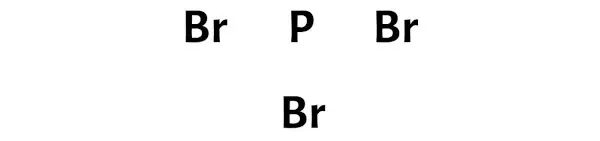
Adım 3: Her atomu aralarına bir çift elektron yerleştirerek bağlayın
Şimdi PBr3 molekülünde elektron çiftlerini fosfor (P) atomu ile bromin (Br) atomları arasına yerleştirmeniz gerekir.
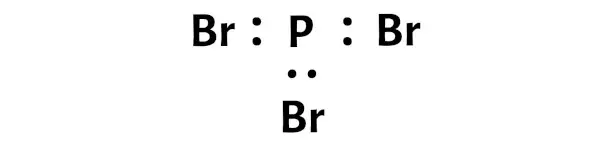
Bu, fosfor (P) ve bromun (Br) bir PBr3 molekülünde birbirine kimyasal olarak bağlandığını gösterir.
Adım 4: Dış atomları kararlı hale getirin. Kalan değerlik elektron çiftini merkez atomun üzerine yerleştirin.
Bu adımda dış atomların kararlılığını kontrol etmeniz gerekir.
Burada PBr3 molekülünün diyagramında dıştaki atomların brom atomları olduğunu görebilirsiniz.
Bu harici brom atomları bir oktet oluşturur ve bu nedenle stabildir.
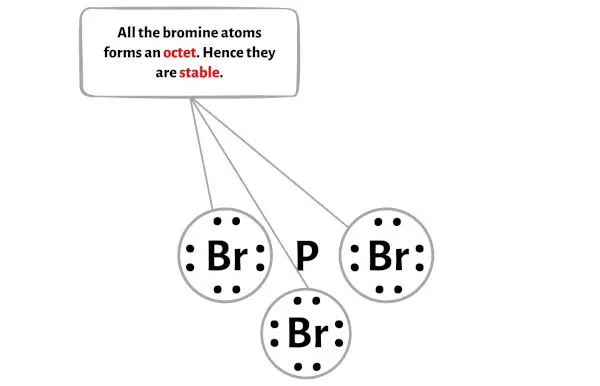
Ek olarak 1. adımda PBr3 molekülünde bulunan toplam değerlik elektron sayısını hesapladık.
PBr3 molekülünün toplam 26 değerlik elektronu vardır ve yukarıdaki diyagramda bunlardan sadece 24 değerlik elektronu kullanılmıştır.
Yani kalan elektron sayısı = 26 – 24 = 2 .
Bu 2 elektronu yukarıdaki diyagramda PBr3 molekülünün merkezi fosfor atomuna yerleştirmeniz gerekir.
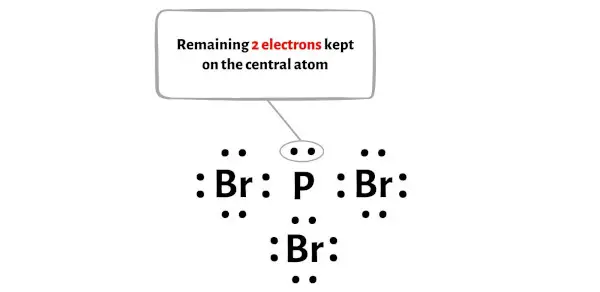
Şimdi bir sonraki adıma geçelim.
Adım 5: Merkezi atomdaki sekizliyi kontrol edin
Bu adımda merkezi fosfor (P) atomunun kararlı olup olmadığını kontrol etmeniz gerekir.
Merkezi fosfor (P) atomunun stabilitesini kontrol etmek için oktet oluşturup oluşturmadığını kontrol etmemiz gerekir.
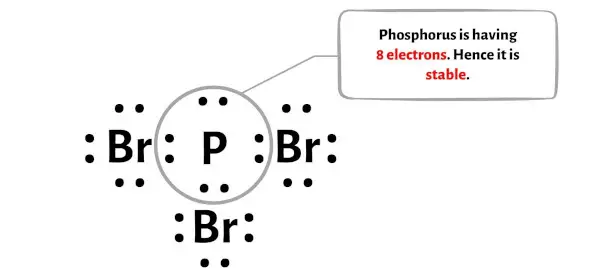
Yukarıdaki resimde fosfor atomunun bir oktet oluşturduğunu görebilirsiniz. Bu, 8 elektrona sahip olduğu anlamına gelir.
Ve bu nedenle merkezi fosfor atomu stabildir.
Şimdi PBr3’ün Lewis yapısının kararlı olup olmadığını kontrol etmek için son adıma geçelim.
Adım 6: Lewis yapısının kararlılığını kontrol edin
Artık PBr3’ün Lewis yapısının kararlılığını kontrol etmeniz gereken son adıma geldiniz.
Lewis yapısının kararlılığı formal yük kavramı kullanılarak doğrulanabilir.
Kısacası, şimdi PBr3 molekülünde bulunan bromin (Br) atomlarının yanı sıra fosfor (P) atomlarının da formal yükünü bulmamız gerekiyor.
Resmi vergiyi hesaplamak için aşağıdaki formülü kullanmanız gerekir:
Resmi yük = Değerlik elektronları – (Bağ elektronları)/2 – Bağ yapmayan elektronlar
Aşağıdaki resimde PBr3 molekülünün her bir atomu için bağlanan elektronların ve bağlanmayan elektronların sayısını görebilirsiniz.
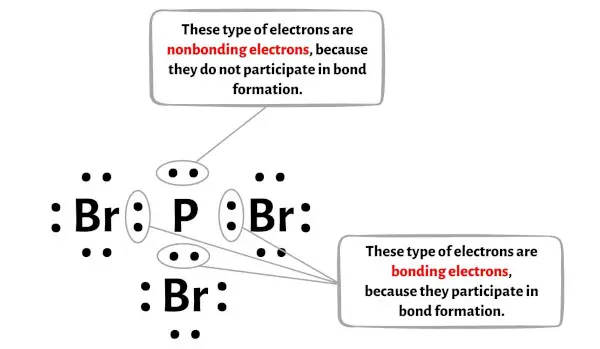
Fosfor atomu (P) için:
Değerlik elektronları = 5 (çünkü fosfor 15. gruptadır)
Bağ elektronları = 6
Bağlanmayan elektronlar = 2
Brom atomu (Br) için:
Değerlik elektronları = 7 (çünkü brom 17. gruptadır)
Bağ elektronları = 2
Bağlanmayan elektronlar = 6
| Resmi suçlama | = | değerlik elektronları | – | (Elektronların bağlanması)/2 | – | Bağlanmayan elektronlar | ||
| P. | = | 5 | – | 6/2 | – | 2 | = | 0 |
| kardeşim | = | 7 | – | 2/2 | – | 6 | = | 0 |
Yukarıdaki formal yük hesaplamalarından, hem fosfor (P) atomunun hem de bromin (Br) atomunun “sıfır” formal yüke sahip olduğunu görebilirsiniz.
Bu, PBr3’ün yukarıdaki Lewis yapısının stabil olduğunu ve PBr3’ün yukarıdaki yapısında artık bir değişiklik olmadığını gösterir.
PBr3’ün yukarıdaki Lewis nokta yapısında, her bir bağ elektronu çiftini (:) tek bir bağ (|) olarak da temsil edebilirsiniz. Bunu yapmak PBr3’ün aşağıdaki Lewis yapısına yol açacaktır.
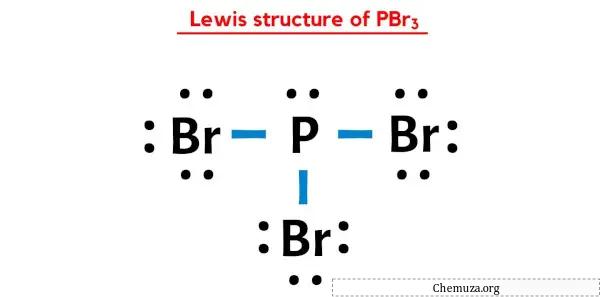
Umarım yukarıdaki tüm adımları tamamen anlamışsınızdır.
Daha fazla pratik yapmak ve daha iyi anlamak için aşağıda listelenen diğer Lewis yapılarını deneyebilirsiniz.
Daha iyi anlamak için şu Lewis yapılarını deneyin (veya en azından görün):
