Gümüş nitrat (AgNO3), gümüş, nitrojen ve oksijenden oluşan kimyasal bir bileşiktir. Fotoğrafçılıkta, tıpta ve çeşitli reaksiyonlar için laboratuvar reaktifi olarak yaygın olarak kullanılır.
| IUPAC Adı | Gümüş nitrat |
| Moleküler formül | AgNO3 |
| CAS numarası | 7761-88-8 |
| Eş anlamlı | Gümüş mononitrat, nitrik asidin gümüş (1+) tuzu, gümüş (I) nitrat |
| InChI | InChI=1S/Ag.NO3/c;2-1(3)4/q+1;-1 |
Gümüş nitratın özellikleri
Gümüş Nitrat Formülü
Gümüş mononitratın formülü AgNO3’tür. Bir gümüş atomu (Ag), bir nitrojen atomu (N) ve üç oksijen atomundan (O) oluşur. Formül, bir gümüş mononitrat molekülündeki atomların oranını temsil eder.
Gümüş Nitrat Molar Kütlesi
Gümüş mononitratın molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanır. Gümüşün atom kütlesi 107,87 g/mol, nitrojenin kütlesi 14,01 g/mol ve her oksijen atomunun kütlesi 16,00 g/mol’dür. Bunların eklenmesi, gümüş mononitrat için yaklaşık 169,87 g/mol’lük bir molar kütle verir.
Gümüş nitratın kaynama noktası
Gümüş mononitrat yaklaşık 440 santigrat derece (824 Fahrenheit) kaynama noktasına sahiptir. Bu sıcaklıkta bileşik, sıvı durumdan gaz durumuna geçişe uğrar. Kaynama noktası, maddenin buhar basıncının atmosfer basıncına eşit olduğu sıcaklığı gösterir.
Gümüş nitrat Erime noktası
Gümüş mononitratın erime noktası yaklaşık 209 santigrat derecedir (408 Fahrenheit). Bu, gümüş mononitratın katı formunun sıvıya dönüştüğü sıcaklıktır. Erime noktası bir maddenin karakteristik bir özelliğidir ve farklı koşullar altında fiziksel davranışının belirlenmesine yardımcı olur.
Gümüş nitratın yoğunluğu g/mL
Gümüş mononitratın yoğunluğu yaklaşık 4,35 g/mL’dir. Yoğunluk, belirli bir hacimde bulunan kütle miktarının bir ölçüsüdür. Bir maddenin kütlesinin hacmine bölünmesiyle hesaplanır. Gümüş mononitratın yoğunluğu, ne kadar kompakt olduğunu veya belirli bir alanda ne kadar konsantre olduğunu gösterir.
Gümüş Nitrat Molekül Ağırlığı
Molar kütle olarak da adlandırılan gümüş mononitratın moleküler ağırlığı yaklaşık 169,87 g/mol’dür. Bir gümüş mononitrat molekülündeki tüm atomların atomik kütlelerinin toplamını temsil eder. Molekül ağırlığı, bileşiğin miktarlarını içeren çeşitli hesaplamalarda ve dönüşümlerde kullanılır.
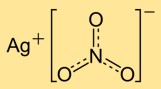
Gümüş nitratın yapısı
Gümüş mononitrat, gümüş katyonlarından (Ag+) ve nitrat anyonlarından (NO3-) oluşan bir kristal yapıya sahiptir. Gümüş iyonları nitrat iyonları ile çevrelenerek düzenli bir ağ oluşturur. Bu iyonik yapı, bileşiğin stabilitesine ve özelliklerine katkıda bulunur.
Gümüş nitratın çözünürlüğü
Gümüş mononitrat suda çok çözünür. Berrak, renksiz bir çözelti oluşturmak için suda kolayca çözünür. Gümüş mononitratın sudaki çözünürlüğü temel bir özelliktir ve tıp, fotoğrafçılık ve kimyasal reaksiyonlar gibi çeşitli uygulamalarda çok önemli bir rol oynar.
| Dış görünüş | Beyaz kristal katı |
| Spesifik yer çekimi | 4,35 gr/ml |
| Renk | Renksiz |
| Koku | Kokusuz |
| Molar kütle | 169,87 gr/mol |
| Yoğunluk | 4,35 gr/ml |
| Füzyon noktası | 209°C (408°F) |
| Kaynama noktası | 440°C (824°F) |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünür |
| çözünürlük | Suda ve etanol gibi organik çözücülerde çözünür |
| Buhar basıncı | 25°C’de (77°F) 0,26 mmHg |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | – |
| pH | Asidik (sulu çözeltide yaklaşık pH 5-6) |
Gümüş Nitrat Güvenliği ve Tehlikeleri
Gümüş mononitrat bazı güvenlik riskleri taşır ve bileşik kullanılırken dikkatli olunmalıdır. Yutulması, solunması veya cilt veya gözlerle teması halinde zararlı olduğu kabul edilir. Eldiven, koruyucu gözlük ve laboratuvar önlüğü gibi koruyucu önlemler kullanılmalıdır. Bu, ciltte ve diğer yüzeylerde tahrişe, yanıklara ve lekelere neden olabilir. Isıtıldığında zehirli nitrojen oksitler açığa çıkarabilir. Uyumsuz maddelerden uzak, serin ve kuru bir yerde saklanmalıdır. Dökülmeler derhal temizlenmeli ve çevrenin kirlenmesini önlemek için atıkların imhası uygun kurallara uygun şekilde yapılmalıdır.
| Tehlike sembolleri | Aşındırıcı, Oksitleyici |
| Güvenlik Açıklaması | Ciddi cilt yanıklarına ve göz hasarına neden olur. |
| Birleşmiş Milletler tanımlayıcıları | UN 1493 (Katı gümüş mononitrat) |
| HS kodu | 2843.10.00 |
| Tehlike sınıfı | Sınıf 5.1 (Oksitleyici malzemeler) |
| Paketleme grubu | GE II (orta seviye) |
| Toksisite | Sudaki yaşam için uzun süreli etkilerle toksiktir. |
Gümüş nitrat sentez yöntemleri
Gümüş mononitrat sentezlemek için farklı yöntemler vardır.
Yaygın bir yöntem, metalik gümüş ve nitrik asit arasındaki reaksiyonu içerir. Bu süreçte seyreltilmiş nitrik asit gümüşü çözerek gümüş mononitrat üretir. Başka bir yöntem, gümüş oksit veya gümüş karbonatın nitrik asitle reaksiyona girerek gümüş mononitrat oluşumunu içerir.
Ayrıca gümüş klorür ile nitrik asit arasındaki reaksiyon da gümüş mononitrat üretebilir. Nitrik asit gümüş klorürü çözer, klorür iyonlarının yerini alır ve gümüş mononitrat oluşturur.
Ek olarak gümüş sülfatın sodyum nitrat gibi çözünür bir nitrat tuzu ile reaksiyonu gümüş mononitratın elde edilmesini sağlar. Gümüş sülfat sulu bir çözeltide nitrat tuzu ile reaksiyona girerek gümüş mononitrat ve çözünür bir sülfat tuzu oluşumuna yol açar.
Bu sentetik yöntemleri uygularken uygun güvenlik önlemlerinin alınması ve aşındırıcı asitlerin ve potansiyel olarak toksik bileşiklerin kullanılması önemlidir. Gümüş mononitratın doğru şekilde hazırlanmasını ve kullanılmasını sağlamak için laboratuvar protokolleri ve yönergeleri de takip edilmelidir.
Gümüş nitratın kullanım alanları
Gümüş mononitratın farklı alanlarda birçok kullanımı vardır. İşte bazı yaygın uygulamalar:
- Fotoğrafçılık: Geleneksel siyah beyaz fotoğrafçılık, ışıkla reaksiyona giren, gümüş parçacıkları oluşturan ve fotoğrafik görüntüler geliştiren, ışığa duyarlı bir bileşik olarak gümüş mononitrat kullanır.
- Tıp: Tıbbi uygulamalar, yara bakımında antiseptik özellikleri nedeniyle gümüş mononitrat kullanır. Topikal uygulaması enfeksiyonları önler, iyileşmeyi hızlandırır ve yanıkları, ülserleri ve diğer cilt yaralarını tedavi eder.
- Laboratuvar Reaktifi: Gümüş mononitrat, çok yönlü bir laboratuvar reaktifi olarak hizmet eder, çeşitli kimyasal reaksiyonlara olanak tanır ve analitik kimyada halojenürlerin ve diğer bileşiklerin varlığını tespit etmek için kullanılır.
- Gümüş Kaplama: Elektrokaplama işlemleri, çeşitli yüzeylere ince bir gümüş tabakasını aktif olarak biriktirmek için gümüş mononitrat kullanır. Bu kullanım dekoratif amaçlı ve korozyona karşı dayanıklılık sağlamak amacıyla yaygındır.
- Boyama ve Boyama: Histoloji ve mikroskopi, biyolojik numunelerdeki belirli yapıların görünürlüğünü etkin bir şekilde geliştirmek için boya olarak gümüş mononitrat kullanır. Tekstil endüstrisi bunu kumaşları boyamak için kullanıyor.
- Gravür: Gümüş mononitratın aşındırıcı doğası, cam ve aynalar üzerindeki desenlerin gravürlenmesinde aktif kullanımına olanak tanır. Yüzey katmanlarını seçici olarak kaldırarak karmaşık desenler oluşturur.
- Kimya Eğitimi: Eğitim kurumları, farklı reaksiyonları ve görsel efektleri nedeniyle kimyasal deneyler ve gösteriler yapmak için gümüş mononitrat’ı aktif olarak kullanıyor.
- Gümüş Katalizörü: Bazı kimyasal reaksiyonlarda gümüş mononitrat aktif olarak katalizör görevi görerek reaktanların istenen ürünlere dönüşümünü kolaylaştırır.
Sorular:
S: AgNO3 suda çözünür mü?
C: Evet, AgNO3 suda çözünür.
S: AgNO3 nedir?
C: AgNO3, gümüş, nitrojen ve oksijenden oluşan kimyasal bir bileşik olan gümüş mononitrattır.
S: KCl(aq) ile AgNO3(aq) arasındaki reaksiyondaki seyirci iyonlar nelerdir?
C: KCl(aq) ve AgNO3(aq) arasındaki reaksiyonda seyirci iyonlar K+ ve NO3-‘dir.
S: AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq) reaksiyonunda, eğer varsa, hangi iyonlar seyirci iyonlardır?
A: AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq) reaksiyonunda seyirci iyonlar Na+ ve NO3-‘dir.
S: 5,8 mol AgNO3 ile reaksiyona girmek için kaç mol Cu gereklidir?
C: Dengeli denklem, 5,8 mol AgNO3 ile reaksiyona girmesi gereken Cu’nun mol sayısını belirlemek için gereklidir.
Soru: Aşağıdaki bileşiklerden hangisi AgNO3 ile çökelti oluşturur?
C: Cl-, Br- veya I- iyonlarını içeren bileşikler AgNO3 ile bir çökelti üretecektir.
S: AgNO3 iyonik bir bileşik midir?
C: Evet, AgNO3 iyonik bir bileşiktir.
S: AgNO3 güçlü bir elektrolit midir?
C: Evet, AgNO3 güçlü bir elektrolittir.
S: AgNO3 elektriği iletir mi?
C: Evet, AgNO3 suda çözündüğünde elektriği iletir.
Soru: Gümüş nitrat bir tuz mudur?
C: Evet, gümüş mononitrat bir tuzdur.
S: Gümüş nitrat satın alabilir miyim?
C: Evet, gümüş mononitrat ticari olarak satın alınabilir.
S: Gümüş nitrat bir çözüm mü?
C: Gümüş mononitrat, durumuna bağlı olarak katı halde veya çözelti halinde bulunabilir.
Soru: Gümüş nitrat lekesi nasıl çıkar?
C: Gümüş mononitrat lekeleri, etkilenen bölgeye hidrojen peroksit veya sodyum tiyosülfat gibi hafif bir indirgeyici madde uygulanarak çıkarılabilir.
Soru: Gümüş nitrat suda çözünür mü?
C: Evet, gümüş mononitrat suda çözünür.
S: Gümüş nitrat ve potasyum kromat çözeltileri karıştırıldığında hangi çökelti oluşur?
C: Gümüş mononitrat ve potasyum kromat çözeltileri karıştırıldığında sarı renkli bir gümüş kromat çökeltisi (Ag2CrO4) oluşur.
Soru: Gümüş nitratın molar kütlesi nedir?
C: Gümüş mononitratın (AgNO3) molar kütlesi yaklaşık 169,87 g/mol’dür.
Soru: Kurşun(II) nitrat çözeltisine metalik gümüş ekleniyor. Dengeli kimyasal reaksiyon nedir?
C: Dengeli kimyasal reaksiyon 2Ag + Pb(NO3)2 → 2AgNO3 + Pb’dir.
