Sodyum amid (NaNH2) kimyasal bir bileşiktir. Sodyum ve nitrojen atomlarından oluşur. Çeşitli kimyasal reaksiyonlarda güçlü bir baz olarak kullanılır.
| IUPAC Adı | Sodyum amid |
| Moleküler formül | NaNH2 |
| CAS numarası | 7782-92-5 |
| Eş anlamlı | Sodamid, sodyum azanit, sodyum amid, sodyum nitrür |
| InChI | InChI=1S/NaN2/c2-1-3/q-1 |
Sodyum amidin özellikleri
Sodyum amid formülü
Sodyum amidin formülü NaNH2’dir. Bir sodyum atomu (Na), bir hidrojen atomu (H) ve bir nitrojen atomundan (N) oluşur. Bu kimyasal formül, moleküler düzeyde sodyum amidin bileşimini temsil eder.
Sodyum Amit Molar Kütle
Sodyum azanitin molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanır. Sodyumun atom kütlesi mol başına 22,99 gramdır (g/mol) ve nitrojenin atom kütlesi 14,01 g/moldür. Bu değerleri topladığımızda sodyum azanitin molar kütlesinin yaklaşık 39 g/mol olduğunu görüyoruz.
Sodyum amidin kaynama noktası
Sodyum azanitin kaynama noktası, sıvıdan gaza dönüştüğü sıcaklıktır. Sodyum azanitin yaklaşık 850 santigrat derece (°C) gibi nispeten yüksek bir kaynama noktası vardır. Bu sıcaklıkta, sodyum azanit moleküllerini bir arada tutan moleküller arası kuvvetlerin üstesinden gelinir ve bunun sonucunda sıvı durumdan gaz durumuna dönüşüm sağlanır.
Sodyum amid Erime noktası
Sodyum azanitin erime noktası, katı halden sıvı hale geçtiği sıcaklıktır. Sodyum azanitin yaklaşık 210 santigrat derece (°C) gibi nispeten düşük bir erime noktası vardır. Bu sıcaklıkta, katı sodyum azanitin kristal kafes yapısı parçalanarak parçacıkların serbestçe hareket etmesine izin vererek bir sıvı oluşturur.
Sodyum amid yoğunluğu g/mL
Sodyum azanitin yoğunluğu birim hacim başına kütlesinin bir ölçüsüdür. Sodyum azanitin yoğunluğu mililitre başına yaklaşık 1,39 gramdır (g/mL). Bu değer sodyum azanitin nispeten yoğun bir madde olduğunu gösterir.
Sodyum Amit Molekül Ağırlığı
Sodyum azanitin moleküler ağırlığı, kimyasal formülündeki tüm atomların atom ağırlıklarının toplamıdır. Sodyum azanitin moleküler ağırlığı mol başına yaklaşık 39 gramdır (g/mol).
Sodyum amidin yapısı
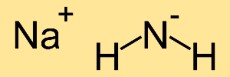
Sodyum azanitin yapısı iki nitrojen (N) atomuna bağlı bir sodyum (Na) atomundan oluşur. Nitrojen atomları ortada sodyum atomu ile doğrusal bir düzenleme oluşturarak doğrusal bir moleküler yapı oluşturur.
Sodyum amidin çözünürlüğü
Sodyum azanit suda çok az çözünür. Su ile reaksiyona girerek sodyum hidroksit (NaOH) ve amonyak (NH3) oluşturur. Ancak sıvı amonyak ve sıvı alkoller gibi bazı organik çözücülerde çözünür. Sodyum azanitin bu çözücüler içindeki çözünürlüğü, çeşitli kimyasal reaksiyonlarda kullanılmasına olanak sağlar.
| Dış görünüş | Beyaz katı |
| Spesifik yer çekimi | 1.39g/ml |
| Renk | Beyaz |
| Koku | Amonyağa benzer |
| Molar kütle | 39 gr/mol |
| Yoğunluk | 1.39g/ml |
| Füzyon noktası | 210°C |
| Kaynama noktası | 850°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Tepki verir |
| çözünürlük | Sıvı amonyak ve sıvı alkoller gibi organik çözücülerde çözünür |
| Buhar basıncı | Uygulanamaz |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Alkali (7’nin üzerinde) |
Sodyum amidin güvenliği ve tehlikeleri
Sodyum azanit, dikkate alınması gereken belirli güvenlik riskleri ve tehlikeleri oluşturur. Suyla şiddetli reaksiyona girerek zehirli amonyak gazı ve aşındırıcı sodyum hidroksit açığa çıkarır. Bu nedenle nem veya suyla temasını önlemek için son derece dikkatli kullanılmalıdır. Sodyum azanit de güçlü bir bazdır ve cilt veya gözlerle teması halinde ciddi yanıklara ve göz hasarına neden olabilir. Tozunun veya buharının solunması solunum sistemini tahriş edebilir. Sodyum azanit ile çalışırken eldiven, gözlük ve solunum cihazı gibi uygun koruyucu ekipmanların kullanılması tavsiye edilir. Yeterli havalandırma ve uyumsuz maddelerden uzakta depolama temel güvenlik önlemleridir.
| Tehlike sembolleri | Aşındırıcı, Zararlı, Zehirli |
| Güvenlik Açıklaması | Çok dikkatli davranın. Su/nem ile temasından kaçının. Koruyucu ekipman giyin. Yeterli havalandırma ve depolama gereklidir. |
| BM kimlik numaraları | BM 1410 |
| HS kodu | 28500020 |
| Tehlike sınıfı | 4,3 (Islandığında tehlikeli), 6,1 (Zehirli), 8 (Aşındırıcı) |
| Paketleme grubu | II |
| Toksisite | Yutulması, solunması veya cilt/göz temasıyla toksiktir |
Sodyum amid sentezi için yöntemler
Sodyum azanitin sentezlenmesi için çeşitli yöntemler vardır.
Yaygın bir yöntem, metalik sodyum ile gaz halindeki amonyak (NH3) arasındaki reaksiyondur. Bu proseste sodyum metali, kontrollü koşullar altında amonyak gazı ile reaksiyona girerek sodyum azanit üretir. Reaksiyon genellikle uygun güvenlik önlemleriyle donatılmış bir reaktör kabında gerçekleşir.
Başka bir yöntem, sodyum hidrit (NaH) ile amonyak gazı arasındaki reaksiyonu içerir. Katı bir bileşik olan sodyum hidrit, amonyak gazı ile reaksiyona girerek sodyum azanit ve hidrojen gazı üretir. İstenmeyen yan reaksiyonları önlemek amacıyla bu reaksiyonu gerçekleştirmek için sıklıkla inert atmosferler kullanılır.
Ek olarak metalik sodyum ile sıvı amonyak arasındaki reaksiyon, sodyum azanitin hazırlanmasına olanak sağlar. Bu yöntem, sodyum metalinin sıvı amonyak içinde çözülmesini ve bunun sonucunda sodyum azanit ve hidrojen gazının oluşmasını içerir.
Sodyum azanidi sentezlemek için sodyum azid (NaN3) , sodyum hidroksit (NaOH) ile reaksiyona girer. Bu iki bileşik arasındaki reaksiyon, nitrojen gazının salınımının yanı sıra sodyum azanit üretir.
Bu sentetik yöntemlerin, sodyum azanit ile ilişkili reaktivite ve tehlikeler nedeniyle uzmanlık ve uygun güvenlik önlemleri gerektirdiği unutulmamalıdır.
Sodyum amidin kullanım alanları
Sodyum azanit benzersiz özelliklerinden dolayı çeşitli alanlarda uygulama alanı bulmaktadır. İşte bazı kullanımları:
- Organik kimya reaksiyonlarında güçlü baz: Sodyum azanit, zayıf asitleri protondan arındırarak çeşitli organik bileşiklerin sentezini kolaylaştırır.
- Reaksiyonlarda nitrojen kaynağı: Sodyum azanit, nitrojen atomlarını organik moleküllere katarak farmasötiklerin, boyaların ve polimerlerin sentezinde çok önemli bir rol oynar.
- Dehidrohalojenasyon: Sodyum azanid, dehidrohalojenasyon reaksiyonlarında hidrojen halojenürleri organik bileşiklerden uzaklaştırır. Bu işlem alkenlerin, alkinlerin ve diğer doymamış bileşiklerin hazırlanmasını kolaylaştırır.
- Halka açma reaksiyonları: Sodyum azanit, Gabriel sentezi gibi siklik bileşiklerin halka açma reaksiyonlarına katılarak siklik aminleri birincil aminlere dönüştürür.
- Kükürt giderme: Sodyum azanit, kükürt atomlarını organik bileşiklerden uzaklaştırarak kükürt giderme reaksiyonlarını mümkün kılabilir. Bu, kükürt içermeyen yakıtların üretiminde ve kükürt içeren bileşiklerin çevresel etkisinin azaltılmasında faydalıdır.
- Hidrojen depolama: Araştırmacılar, sodyum azanitin hidrojen depolama sistemlerinde potansiyel kullanımını araştırdı. Hidrojen gazı ile reaksiyona girerek sodyum hidrit oluşturabilir ve bu daha sonra ısıtıldığında hidrojeni serbest bırakabilir.
- Katalizör desteği: Sodyum azanit, belirli katalitik reaksiyonların performansını artıran bir katalizör desteği görevi görebilir. Çeşitli kimyasal dönüşümlerde katalizörlerin stabilitesini sağlar ve verimliliğini artırır.
Genel olarak, sodyum azanitin çok yönlü özellikleri onu organik sentez, nitrojen kimyası ve diğer endüstriyel uygulamalarda değerli bir bileşik haline getirir.
Sorular:
S: NaNH2 ne işe yarar?
C: NaNH2, organik kimya reaksiyonlarında zayıf asitleri protondan arındırmak ve çeşitli dönüşümleri kolaylaştırmak için yaygın olarak kullanılan güçlü bir bazdır.
S: NaNH2 nedir?
A: NaNH2, genellikle organik sentezde reaktif ve güçlü baz olarak kullanılan, sodyum (Na) ve azanit (NH2) iyonlarından oluşan kimyasal bir bileşik olan sodyum amiddir.
S: Aşırı NaNH2 ne için kullanılır?
C: Aşırı NaNH2, bir reaksiyonda asidik hidrojen atomlarının ilave protonsuzlaşmasına yol açabilir, dolayısıyla protonsuzlaşmanın kapsamını artırabilir ve reaksiyonun sonucunu potansiyel olarak değiştirebilir.
S: NaNH2 bir alkene ne yapar?
C: NaNH2, bir alkenden bir hidrojen atomu çıkarabilir, bu da bir alkan ve bir sodyum alkoksit bileşiğinin oluşmasına neden olur.
S: NaNH2 bromobenzene ne yapar?
C: NaNH2, bir nükleofilik ikame reaksiyonu yoluyla bromobenzen içindeki bromin atomunun yerini alabilir ve sonuçta sodyum fenilamin oluşumuna neden olabilir.
S: NaNH2 güçlü bir baz mıdır?
C: Evet, NaNH2, amid iyonunun varlığı nedeniyle protonları kabul edebilen ve zayıf asitleri protondan arındırabilen güçlü bir bazdır.
Soru: NaNH2/NH3 karışımına H2O eklenirse hangi reaksiyon gerçekleşir?
A: Bir NaNH2/NH3 karışımına H2O eklenmesi, su ile güçlü baz NaNH2 arasındaki reaksiyon nedeniyle amonyak gazı (NH3) ve sodyum hidroksit (NaOH) oluşumuyla sonuçlanır.
S: Bu reaksiyonda hangi ara ürün yer alıyor: NaNH2 + sıvı NH3?
C: NaNH2’nin sıvı NH3 ile reaksiyonunda yer alan ara madde, sodyumdan amonyağa bir elektronun bağışlanmasıyla oluşan solvatlanmış bir elektrondur.
S: NaNH2 iyi bir nükleofil midir?
C: Evet, NaNH2, bir elektron çifti bağışlama ve nükleofilik ikame reaksiyonlarına katılma yeteneği nedeniyle iyi bir nükleofil görevi görebilir.
S: NaNH2 iyonik mi yoksa kovalent mi?
A: NaNH2, pozitif yüklü sodyum iyonlarından (Na+) ve negatif yüklü amid iyonlarından (NH2-) oluşan iyonik bir bileşiktir.
S: 2-heksin sodyum amid ile reaksiyona girecek mi?
C: Evet, 2-heksin sodyum amid ile reaksiyona girerek sodyum asetilit ve karşılık gelen alkin bileşiğinin oluşmasına neden olabilir.
S: Sodyum amid ve sodyum fenoksat arasında en güçlü baz hangisidir?
C: Sodyum azanit, amid iyonunun (NH2-) fenoks iyonuna (C6H5O-) kıyasla daha fazla bazik olması nedeniyle sodyum fenoksattan daha güçlü bir bazdır.
