Fosfor oksiklorür (POCl3), çeşitli endüstriyel işlemlerde kullanılan kimyasal bir bileşiktir. Su ile reaksiyona girerek fosforik asit ve hidroklorik asit oluşturur.
| IUPAC Adı | Fosfor oksiklorür |
| Moleküler formül | POCl3 |
| CAS numarası | 10025-87-3 |
| Eş anlamlı | Fosforil klorür, fosforil triklorür, fosfor triklorür |
| InChI | InChI=1S/Cl3OP/c1-4(2)3 |
Fosfor oksiklorürün özellikleri
Fosfor Oksiklorür Formülü
Fosforil klorürün kimyasal formülü POCl3’tür. P ile sembolize edilen bir fosfor (P) atomu ve Cl ile sembolize edilen üç klor (Cl) atomundan oluşur. Formül, bileşikte bulunan her bir elementin oranını gösterir.
Fosfor Oksiklorür Molar Kütlesi
Fosforil klorürün molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Fosforun molar kütlesi 30,97 g/mol iken klorun molar kütlesi 35,45 g/mol’dür. Klorun molar kütlesini 3 ile çarpmak ve fosforun molar kütlesini eklemek, fosforil klorür için yaklaşık 153,33 g/mol’lük toplam molar kütleyi verir.
Fosfor oksiklorürün kaynama noktası
Fosforil klorürün kaynama noktası yaklaşık 105,5°C’dir. Bu sıcaklık, standart atmosferik basınç altında sıvı bileşiğin gaz haline dönüştüğü noktayı temsil eder. Kaynama noktası, fosforil klorürün işlenmesini ve uygulanmasını etkileyen önemli bir özelliktir.
Fosfor oksiklorür Erime noktası
Fosforil klorürün erime noktası yaklaşık -112,5°C’dir. Bu, katı bileşiğin sıvı duruma geçtiği sıcaklık anlamına gelir. Erime noktası depolama ve taşıma açısından kritik bir parametredir.
Fosfor oksiklorürün yoğunluğu g/mL
Fosforil klorürün yoğunluğu yaklaşık 1,65 g/mL’dir. Yoğunluk, bir maddenin birim hacmi başına kütle miktarını ifade eder. Daha yüksek bir yoğunluk, belirli bir hacimde daha fazla parçacık konsantrasyonu anlamına gelir.
Fosfor Oksiklorür Molekül Ağırlığı
Fosforil klorürün moleküler ağırlığı, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanır. Fosforun molekül ağırlığı yaklaşık 30,97 g/mol iken klorun molekül ağırlığı 35,45 g/mol’dür. Ağırlıklı kütlelerin eklenmesiyle fosforil klorür için yaklaşık 153,33 g/mol moleküler ağırlık elde edilir.
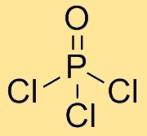
Fosfor oksiklorürün yapısı
Fosforil klorür, bir fosfor atomunun üç klor atomuna ve bir oksijen atomuna bağlandığı moleküler bir yapıya sahiptir. Klor atomları merkezi fosfor atomunun etrafında simetrik olarak düzenlenir ve oksijen atomu da fosfor atomuna bağlanır. Bu düzenleme tetrahedral bir geometri oluşturur.
Fosfor oksiklorürün çözünürlüğü
Fosforil klorür suda çok az çözünür ancak benzen, karbon tetraklorür ve kloroform gibi organik çözücülerde kolaylıkla çözünür. Çözünürlük davranışı, molekülün polar yapısına ve oksijen ve klor gibi elektronegatif atomların varlığına bağlanır.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 1.645 gr/ml |
| Renk | Renksiz |
| Koku | Dönüm |
| Molar kütle | 153,33 gr/mol |
| Yoğunluk | 1.645 gr/ml |
| Füzyon noktası | -112,5°C |
| Kaynama noktası | 105,5°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Şiddetli tepki veriyor |
| çözünürlük | Benzen, karbon tetraklorür ve kloroform gibi organik çözücülerde çözünür |
| Buhar basıncı | 20°C’de 11 mmHg |
| Buhar yoğunluğu | 5,29 (Hava = 1) |
| pKa | Uygulanamaz |
| pH | Uygulanamaz |
Fosfor oksiklorürün güvenliği ve tehlikeleri
Fosforil klorür güvenlik tehlikeleri oluşturur ve dikkatli kullanım gerektirir. Cilt, gözler ve solunum sistemi için aşındırıcıdır. Temas ciddi yanıklara ve göz hasarına neden olabilir. Dumanlarının veya buharlarının solunması solunum yollarını tahriş edebilir. Bu bileşikle çalışırken eldiven ve gözlük gibi uygun kişisel koruyucu ekipmanlar giyilmelidir. Ateşleme kaynaklarından uzakta, iyi havalandırılmış bir alanda saklanmalıdır. Maruz kalınması halinde derhal tıbbi müdahale gereklidir. Ayrıca zehirli buharların salınmasını önlemek için çeker ocak altında kullanılmalıdır.
| Tehlike sembolleri | Aşındırıcı, Tehlike |
| Güvenlik Açıklaması | Aşındırıcı. Ciddi cilt yanıklarına ve göz hasarına neden olur. Solunması veya yutulması halinde zararlı olabilir. Temastan ve solumaktan kaçının. |
| BM kimlik numaraları | 1810 |
| HS kodu | 2812.10.00 |
| Tehlike sınıfı | Sınıf 8 (aşındırıcı maddeler) |
| Paketleme grubu | Ambalajlama grubu III (küçük tehlike) |
| Toksisite | Fosforil klorür zehirlidir ve ciddi sağlık etkilerine neden olabilir. |
Fosfor oksiklorürün sentezi için yöntemler
Fosforil klorür çeşitli yöntemlerle sentezlenebilir. Yaygın bir yöntem , fosfor triklorür (PCl3) ile oksijen (O2) arasındaki reaksiyonu içerir. Bu işlemde PCl3 , aşırı oksijen varlığında ısıtılarak fosforil klorür oluşturulur. Reaksiyon ekzotermiktir ve genellikle reaktör kabı gibi kontrollü bir ortamda meydana gelir.
Başka bir sentez yöntemi, fosfor pentoksit (P2O5) ile fosfor triklorür arasındaki reaksiyonu içerir. P2O5 bir dehidrasyon maddesi görevi görür ve PCl3 ile birleştirildiğinde fosforil klorür oluşturur.
Ek olarak fosforil klorür, fosfor tribromürün (PBr3) ve fosfor pentoksitin reaksiyonuyla sentezlenebilir. Bu reaksiyon fosforil klorür ve fosfor pentabromid oluşumuna yol açar.
Ek olarak, fosforun doğrudan klorlanması da fosforil klorür üretebilir. Bu işlemde klor gazı ısıtılmış fosforun üzerinden geçerek fosforil klorürün oluşmasına neden olur.
İlgili bileşiklerin reaktivitesi ve tehlikeli doğası nedeniyle bu sentetik yöntemlerin dikkatli bir şekilde uygulanması gerektiğine dikkat etmek önemlidir. Fosforil klorürün güvenli kullanımını ve sentezini sağlamak için koruyucu ekipman kullanımı ve kontrollü reaksiyon koşulları dahil uygun güvenlik protokollerine uyulmalıdır.
Fosfor Oksiklorürün Kullanım Alanları
Fosforil klorür, benzersiz özelliklerinden dolayı farklı endüstrilerde çeşitli uygulamalar bulur. İşte bazı yaygın kullanımlar:
- Kimyasal sentez: Organik kimya, fosfonik asitler, esterler ve amidler dahil olmak üzere çeşitli bileşikler üretmek için çok yönlü bir reaktif olarak fosforil klorürü yaygın olarak kullanır.
- Tarımsal Kimyasallar: Bitki koruma ve haşere kontrolünde pestisit ve herbisitlerin sentezi, önemli bir rol oynayan anahtar bileşen olarak fosforil klorür ile ilgilidir.
- İlaç endüstrisi: Farmasötik ara ürünlerin ve aktif farmasötik bileşenlerin (API’ler) üretiminde, antimalaryal ve antiinflamatuar ilaçlar gibi önemli ilaçların sentezini kolaylaştıran fosforil klorür kullanılır.
- Polimer endüstrisi: Polimer üretiminde fosforil klorür, katalizör ve klorlama maddesi görevi görerek malzemelerin yangına dayanıklılığını artıran alev geciktirici katkı maddelerinin sentezine katkıda bulunur.
- Boyaların ve pigmentlerin imalatı: Fosforil klorür, boyaların ve pigmentlerin üretiminde, özellikle tekstil, mürekkep ve kaplamalarda kullanılan boyaların geliştirilmesi için gerekli bileşikler olan kloroalkil fosfonatların hazırlanmasında uygulama alanı bulur.
- Laboratuvar Reaktifi: Alkollerin alkil klorürlere dönüştürülmesi ve fosforile edici maddelerin hazırlanması da dahil olmak üzere çeşitli laboratuvar prosedürlerinde reaktif olarak fosforil klorür kullanılır.
- Su Arıtma: Su arıtma prosesleri, pH seviyelerini kontrol etmek ve yabancı maddeleri gidermek için asitleştirici ve dezenfekte edici bir madde olarak fosforil klorür kullanır.
- Alev Geciktiriciler: Fosforil klorür, tekstil, plastik ve inşaat malzemelerinin yangın güvenliği özelliklerini geliştirerek alev geciktirici malzemelerin üretiminde rol oynar.
Bu çeşitli uygulamalar, birçok endüstriyel sektörde fosforil klorürün önemini ortaya koymakta ve kimyasal sentez, tarım, ilaç ve malzeme bilimindeki önemli rolünü vurgulamaktadır.
Sorular
S: POCl3’ün moleküler geometrisi nedir?
C: POCl3’ün moleküler geometrisi trigonal piramidaldir.
S: Bileşik A, POCl3 ve piridin ile dehidre edildiğinde oluşan başlıca alken nedir?
A: Bileşik A’nın POCl3 ve piridin ile dehidrasyonu sırasında oluşan ana alken, bileşik A’nın spesifik yapısına bağlıdır.
S: POCl3 polar mı yoksa polar değil mi?
C: POCl3, polar bağların varlığı ve asimetrik moleküler şekil nedeniyle polar bir moleküldür.
S: Ne kadar POCl3 gazı üretilebilir?
C: Üretilen POCl3 gazının hacmi, reaktanların miktarına ve spesifik reaksiyon koşullarına bağlıdır.
S: 10,0 gram POCl3’te kaç mol POCl3 bulunur?
C: 10,0 gram POCl3’te yaklaşık 0,082 mol POCl3 bulunur.
S: POCl3’teki P’nin elektron çifti geometrisi nedir?
C: POCl3’teki P’nin elektron çifti geometrisi tetrahedraldir.
S: POCl3’ün dipol momenti var mı?
C: Evet, POCl3’ün polar bağların varlığı ve moleküler geometrisi nedeniyle bir dipol momenti vardır.
S: POCl3’ün rezonansı var mı?
C: Hayır, POCl3 rezonans göstermez çünkü delokalize elektronlar veya çoklu rezonans yapıları yoktur.
S: POCl3’teki oksijen atomunun etrafındaki elektronik alanın geometrisi nedir?
C: POCl3’teki oksijen atomunun etrafındaki elektronik alanın geometrisi trigonal piramidaldir.
S: 72,3 mililitre POCl3 tamamen reaksiyona girdiğinde hangi hacimde H3PO4 oluşacaktır?
C: 72,3 mililitre POCl3 tamamen reaksiyona girdiğinde oluşan H3PO4 hacmi reaksiyonun stokiyometrisine bağlıdır ve tek başına sağlanan bilgilere dayanarak belirlenemez.
