Fosfor tribromür (PBr3), bir fosfor atomu ve üç bromin atomundan oluşan bir bileşiktir. Çeşitli kimyasal reaksiyonlarda, özellikle organik bileşiklerin sentezinde reaktif olarak kullanılır.
| IUPAC Adı | Fosfor tribromür |
| Moleküler formül | PBr3 |
| CAS numarası | 7789-60-8 |
| Eş anlamlı | Fosfor(III) bromür, bromofosfor bromür, tribromofosfin |
| InChI | InChI=1S/Br3P/c1-4(2)3 |
Fosfor tribromürün özellikleri
Fosfor Tribromür Formülü
Fosfor(III) bromürün formülü PBr3’tür. Bir fosfor atomu ve üç brom atomundan oluşur. Bu bileşik, fosfor brom ile reaksiyona girdiğinde oluşur. Formül, bileşiğin bileşimini doğru bir şekilde temsil eder.
Fosfor Tribromid Molar Kütlesi
Fosfor(III) bromürün molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Fosforun atom kütlesi mol başına yaklaşık 31,0 gram, bromun ise mol başına yaklaşık 79,9 gram atomik kütlesi vardır. Fosforun atom kütlesine bromun atom kütlesinin üç katını eklemek bize fosfor(III) bromürün molar kütlesini verir; bu da mol başına yaklaşık 270,7 gramdır.
Fosfor tribromürün kaynama noktası
Fosfor (III) bromürün kaynama noktası yaklaşık 173 santigrat derecedir. Bu, bu noktanın üzerindeki sıcaklıklarda bileşiğin sıvıdan gaza faz değişimine uğrayacağı anlamına gelir. Kaynama noktası, bileşiğin kullanılabileceği veya saflaştırılabileceği koşulların belirlenmesine yardımcı olan önemli bir özelliktir.
Fosfor Tribromür Erime Noktası
Fosfor(III) bromürün erime noktası yaklaşık -41 santigrat derecedir. Bu sıcaklık, bileşiğin katı halden sıvı duruma geçtiği noktayı gösterir. Erime noktasının bilinmesi, bileşiğin çeşitli kimyasal işlemlerde kullanılması ve manipüle edilmesi açısından çok önemlidir.
Fosfor tribromürün yoğunluğu g/mL
Fosfor(III) bromürün yoğunluğu mililitre başına yaklaşık 2,85 gramdır (g/mL). Yoğunluk, bir maddenin birim hacim başına kütlesini ölçer. Nispeten yüksek yoğunluğuyla fosfor(III) bromür, diğer birçok yaygın sıvıdan daha yoğundur, bu da hacmine göre nispeten ağır olduğunu gösterir.
Fosfor Tribromür Molekül Ağırlığı
Fosfor(III) bromürün moleküler ağırlığı mol başına yaklaşık 270,7 gramdır. Bu değer, PBr3 moleküler formülüne dayalı olarak bileşikteki tüm atomların atomik kütlelerinin eklenmesiyle hesaplanır. Molekül ağırlığı, belirli bir kütlede bulunan madde miktarının belirlenmesi de dahil olmak üzere çeşitli hesaplamalarda faydalıdır.
Fosfor tribromürün yapısı
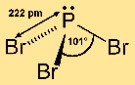
Fosfor (III) bromür piramidal bir moleküler yapıya sahiptir. Üç brom atomuna bağlı merkezi bir fosfor atomundan oluşur. Bu düzenleme, moleküle, fosfor atomunun üstte ve bromin atomlarının tabanda olduğu bir üçgen piramit şekli verir. Bu yapı, bileşiğin kimyasal reaksiyonlardaki reaktivitesini ve davranışını anlamak için önemlidir.
Fosfor tribromürün çözünürlüğü
Fosfor (III) bromür suda çok az çözünür. Hidrobromik asit ve fosfor asit üretmek için suyla reaksiyona girer. Ancak benzen ve karbon tetraklorür gibi organik çözücülerde çözünür. Çözünürlük, bir bileşiğin belirli bir çözücü içinde ne ölçüde çözülebileceğini belirler; bunun çeşitli işlemlerde uygulamaları ve işlenmesi üzerinde etkileri vardır.
| Dış görünüş | Renksiz sıvı |
| Spesifik yer çekimi | 2.85g/ml |
| Renk | Renksiz |
| Koku | Dönüm |
| Molar kütle | 270,7 g/mol |
| Yoğunluk | 2.85g/ml |
| Füzyon noktası | -41°C |
| Kaynama noktası | 173°C |
| Flaş noktası | Müsait değil |
| sudaki çözünürlük | Tepki verir |
| çözünürlük | Benzen ve karbon tetraklorür gibi organik çözücülerde çözünür |
| Buhar basıncı | Müsait değil |
| Buhar yoğunluğu | Müsait değil |
| pKa | Müsait değil |
| pH | Müsait değil |
Fosfor tribromürün güvenliği ve tehlikeleri
Fosfor(III) bromür bazı güvenlik riskleri oluşturur ve dikkatli kullanılmalıdır. Aşındırıcıdır ve ciltle, gözlerle veya solunum sistemiyle teması halinde ciddi yanıklara neden olabilir. Bu bileşiğin solunması veya doğrudan yutulması, solunum ve mide-bağırsak tahrişine neden olabilir. Suyla şiddetli reaksiyona girerek zehirli dumanlar çıkarır ve ısı üretir. Fosfor(III) bromür ile çalışırken yeterli havalandırma ve eldiven ve gözlük gibi kişisel koruyucu ekipman kullanılmalıdır. Ayrıca potansiyel reaksiyonları önlemek için uyumsuz maddelerden uzakta saklanmalıdır. Genel olarak, güvenlik protokollerine sıkı sıkıya bağlı kalmak ve bu bileşikle ilişkili tehlikelere ilişkin bilgi, güvenli kullanım için çok önemlidir.
| Tehlike sembolleri | Aşındırıcı |
| Güvenlik Açıklaması | Depozito ile işlem yapın. Cilt, göz ve solunum sistemi ile temasından kaçının. Yeterli havalandırma ve kişisel koruyucu ekipman kullanın. Uyumsuz maddelerden uzakta saklayın. |
| BM kimlik numaraları | UN1805 |
| HS kodu | 2812.90.90 |
| Tehlike sınıfı | 8 (Aşındırıcı) |
| Paketleme grubu | II |
| Toksisite | Solunması ve yutulması halinde toksiktir. Ciddi yanıklara ve tahrişe neden olabilir. |
Fosfor tribromürün sentezi için yöntemler
Fosfor(III) bromürün sentezlenmesine yönelik yaygın bir yöntemde, reaksiyon kabı, genellikle kontrollü koşullar altında, elementel fosfor ve bromu doğrudan birleştirir. Reaksiyon, brom atomlarının fosfor atomlarına aktarılmasıyla ilerler ve fosfor(III) bromürün oluşumuyla sonuçlanır.
Başka bir yöntem , fosfor triklorür (PCl3) ile hidrojen bromür (HBr) arasındaki reaksiyonu içerir. Bu yaklaşımda, fosfor triklorür ilk önce hidrojen bromür gazıyla reaksiyona girerek yan ürünler olarak fosfor(III) bromür ve hidrojen klorür gazı üretir. Bu yöntem fosfor(III) bromür elde etmek için alternatif bir yol sunar.
“Kırmızı fosfor yöntemi”nde kırmızı fosfor, brom veya hidrobromik asit ile birleştirilir ve reaksiyon kontrollü koşullar altında gerçekleştirilir. Kırmızı fosfor, fosfor (III) bromür üretmek için brom veya hidrobromik asit ile reaksiyona girerek bir fosfor kaynağı görevi görür.
Bu sentetik yöntemler, her birinin kendi avantajları ve hususları olan fosfor(III) bromür üretimi için yollar açar. Yöntemin seçimi reaktifin mevcudiyeti, istenen verim ve spesifik reaksiyon koşulları gibi faktörlere bağlıdır. Bu sentezlerin iyi donanımlı bir laboratuvarda, ilgili kimyasalların işlenmesine ilişkin güvenlik protokollerine ve prosedürlerine uyularak gerçekleştirilmesi önemlidir.
Fosfor Tribromürün Kullanım Alanları
Fosfor(III) bromür, reaktivitesi ve benzersiz özellikleri nedeniyle çeşitli uygulamalar bulur. İşte bazı kullanımları:
- Organik sentez: Kimyacılar, birçok organik bileşiğin sentezinde önemli bir adım olan alkolleri alkil bromitlere dönüştürmek için organik sentezde bir reaktif olarak fosfor(III) bromürü yaygın olarak kullanırlar.
- İlaç Endüstrisi: İlaç üretimi, çeşitli ilaç ara maddelerini ve aktif farmasötik bileşenleri (API) sentezlemek için büyük ölçüde fosfor(III) bromüre dayanır.
- Alev geciktiriciler: Üreticiler alev geciktiricilerin üretiminde fosfor(III) bromür kullanarak elektronik ve tekstil gibi endüstrilerde kullanılmak üzere belirli polimerlerin yangına dayanıklılık özelliklerini geliştirirler.
- Kimyasal üretim: Fosfor(III) bromür, fosforik asit türevleri, fosfonatlar ve fosfatlar gibi fosfor bileşikleri de dahil olmak üzere diğer kimyasalların üretiminde değerli bir ara madde olarak hizmet eder.
- Herbisitler ve Pestisitler: Herbisitler ve pestisitlerde kullanılan spesifik aktif bileşenlerin sentezinde, tarımdaki yabani otları, zararlı böcekleri ve hastalıkları etkili bir şekilde kontrol etmek için fosfor(III) bromür kullanılır.
- Laboratuvar Araştırması: Laboratuvarda araştırmacılar, özellikle brominasyon ve organik bileşiklerin manipülasyonunu içeren çeşitli deneylerde ve reaksiyonlarda reaktif olarak fosfor(III) bromürü yaygın olarak kullanırlar.
- Kimyasal analiz: Fosfor(III) bromür, kimyasal analiz tekniklerinde uygulama alanı bulur ve brom ikame reaksiyonları yoluyla organik bileşiklerdeki belirli fonksiyonel grupların varlığının belirlenmesine olanak tanır.
Bu çeşitli kullanımlar, organik sentezde, farmasötiklerde, alev geciktiricilerde, kimyasal üretimde, tarımda, laboratuvar araştırmalarında ve kimyasal analizlerde fosfor(III) bromürün önemini vurgulamaktadır. Reaktivitesi ve çok yönlülüğü onu çeşitli endüstrilerde ve bilimsel disiplinlerde değerli bir bileşik haline getirir.
Sorular:
S: Neden AlBr3’e alüminyum bromür denirken PBr3’e fosfor tribromür deniyor?
C: Metal içeren bileşiklerin adlandırma kuralında genellikle metalin elementel adı ve ardından ametalin adı kullanılır; PBr3 durumunda ise fosfor, merkezi bir fosfor atomunun varlığını belirtmek için belirtilir.
S: Hangi kelime veya iki kelimelik ifade fosfor tribromürün formunu en iyi şekilde tanımlar?
C: Fosfor(III) bromürün şekli en iyi şekilde trigonal piramidal olarak tanımlanır.
S: Fosfor tribromür PBr3 molekülünde kaç değerlik elektronu vardır?
C: Fosfor(III) bromürün (PBr3) 26 değerlik elektronu vardır.
S: Fosfor tribromür iyonik mi yoksa kovalent mi?
A: Fosfor(III) bromür (PBr3) kovalent bir bileşiktir.
S: Fosfor tribromürün kimyasal formülü nedir?
C: Fosfor(III) bromürün kimyasal formülü PBr3’tür.
S: Fosfor tribromür PBr3 için Lewis yapısı?
C: PBr3’ün Lewis yapısı, fosforu, her biri tek bir bağla bağlanan üç bağlı brom atomu ile çevrelenmiş merkezi atom olarak gösterir.
S: PBr3 bir inversiyon mudur?
C: Hayır, fosfor(III) bromür (PBr3) inversiyon göstermez.
S: PBr3 bir elektrofil midir?
C: Evet, PBr3, elektronları kabul ettiği belirli reaksiyonlarda elektrofil gibi davranabilir.
S: PBr3’ün moleküler geometrisi nedir?
C: PBr3’ün moleküler geometrisi trigonal piramidaldir.
S: PBr3 polar mı yoksa polar değil mi?
C: PBr3, polar P-Br bağlarının varlığından kaynaklanan elektron yoğunluğunun eşit olmayan dağılımı nedeniyle polar bir moleküldür.
S: Kaç mol PBr3 3,68 × 10^25 brom atomu içerir?
C: Mol sayısını belirlemek için PBr3’ün molar kütlesine ihtiyacımız var, ardından verilen brom atomu sayısını Avogadro sayısına bölüyoruz.
S: PBr3’ün doğru adı nedir?
C: PBr3’ün doğru adı fosfor(III) bromürdür.
S: PBr3 polar mıdır?
C: Evet, PBr3, polar bağların varlığı ve eşit olmayan elektron yoğunluğu dağılımı nedeniyle polar bir moleküldür.
