Tiyonil klorür, çeşitli endüstriyel uygulamalarda kullanılan kimyasal bir bileşiktir. Alkoller ve karboksilik asitlerle reaksiyona girerek sırasıyla ilgili klorürleri ve sülfüril klorürü üretir.
| IUPAC’ın adı | Tiyonil klorür |
| Moleküler formül | SOCl₂ |
| CAS numarası | 7719-09-7 |
| Eş anlamlı | Kükürt diklorür, Kükürt oksiklorür, Tiyonil diklorür |
| InChI | InChI=1S/Cl2OS/c1-4(2)3 |
Tiyonil klorürün özellikleri
Tiyonil Klorür Formülü
Tiyonil diklorürün formülü, iki klor atomuna bağlı bir kükürt atomunu temsil eden SOCl₂’dir. Çeşitli endüstrilerde yaygın olarak kullanılan kimyasal bir bileşiktir.
Tiyonil Klorür Molar Kütlesi
Tiyonil diklorürün molar kütlesi mol başına yaklaşık 118,97 gramdır. Molar kütle, onu oluşturan elementlerin atom kütlelerinin eklenmesiyle belirlenir.
Tiyonil klorürün kaynama noktası
Tiyonil diklorürün kaynama noktası yaklaşık 79,6 santigrat derecedir. Bu, tiyonil diklorürün sıvı formunun gaz haline dönüştüğü sıcaklıktır.
Tiyonil klorürün erime noktası
Tiyonil diklorürün erime noktası yaklaşık -104,5 santigrat derecedir. Bu, tiyonil diklorürün katı formunun sıvı duruma geçtiği sıcaklıktır.
Tiyonil klorürün yoğunluğu g/mL
Tiyonil diklorürün yoğunluğu mililitre başına yaklaşık 1,64 gramdır. Yoğunluk birim hacim başına kütlenin ölçüsüdür ve bir maddenin önemli bir özelliğidir.
Tiyonil Klorür Molekül Ağırlığı
Tiyonil diklorürün moleküler ağırlığı mol başına yaklaşık 118.97 gramdır. Kükürt, klor ve oksijenin atom ağırlıkları toplanarak hesaplanır.
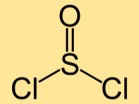
Tiyonil klorürün yapısı
Tiyonil diklorürün yapısı iki klor atomuna bağlı bir kükürt atomundan oluşur. Kükürt ve klor atomları doğrusal olarak düzenlenerek kavisli şekilli bir molekül oluşturur.
Tiyonil klorürün çözünürlüğü
Tiyonil diklorür suda çok az çözünür ancak benzen, toluen ve karbon tetraklorür gibi organik çözücülerde kolaylıkla çözünür. Çözünürlüğü uygulamalarında önemli bir faktördür.
| Dış görünüş | Renksiz ila soluk sarı sıvı |
| Spesifik yer çekimi | 1.638 g/mL |
| Renk | Renksiz |
| Koku | Keskin, boğucu |
| Molar kütle | 118,97 gr/mol |
| Yoğunluk | 1.638 g/mL |
| Füzyon noktası | -104,5°C |
| Kaynama noktası | 79,6°C |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Şiddetli tepki veriyor |
| çözünürlük | Benzen, toluen ve karbon tetraklorür gibi organik çözücülerde çözünür |
| Buhar basıncı | 20°C’de 4,33 kPa |
| Buhar yoğunluğu | 3,9 (hava = 1) |
| pKa | -6.3 |
| pH | Uygulanamaz |
Tiyonil klorürün güvenliği ve tehlikeleri
Tiyonil diklorür çeşitli güvenlik riskleri taşır ve dikkatle kullanılmalıdır. Çok aşındırıcıdır ve ciltle, gözlerle veya mukozayla teması halinde ciddi yanıklara neden olabilir. Buharlarının solunması tahrişe ve solunum hasarına neden olabilir. Bileşik suyla şiddetli reaksiyona girerek hidrojen klorür gibi zehirli gazlar açığa çıkarır. Bu nedenle nem kaynaklarından uzakta saklanmalı ve kullanılmalıdır. Tiyonil diklorür ayrıca alkoller ve su içeren bileşiklerle de güçlü bir şekilde reaksiyona girerek yangın veya patlama tehlikesine neden olabilir. Tiyonil diklorürün güvenli bir şekilde kullanılmasını sağlamak için yeterli havalandırma, kişisel koruyucu ekipman ve uygun depolama uygulamaları şarttır.
| Tehlike sembolleri | Aşındırıcı (C), Toksik (T), Çevreye Tehlikeli (N) |
| Güvenlik Açıklaması | – Nem kaynaklarından ve uyumsuz maddelerden uzak tutun.<br>- İyi havalandırılmış bir alanda kullanın ve uygun kişisel koruyucu ekipman kullanın.<br>- Cilt, göz ve mukoza ile temasını önlemek için dikkatli kullanın.<br> – Sıkıca kapatılmış bir kapta, serin ve kuru bir yerde saklayın. |
| BM kimlik numaraları | UN No. 1836 (Tiyonil diklorür) |
| HS kodu | 2812.10.00 |
| Tehlike sınıfı | 8 (Aşındırıcı maddeler) |
| Paketleme grubu | II (Orta derecede tehlikeli) |
| Toksisite | Solunması, yutulması ve cilt tarafından emilmesi çok toksiktir.<br>- Ciddi yanıklara ve solunum yolu tahrişine neden olabilir.<br>- Sudaki organizmalar üzerinde uzun süreli zararlı etkilere neden olabilir. |
Tiyonil klorürün sentezi için yöntemler
Farklı yöntemler tiyonil diklorürün sentezine izin verir.
Yaygın bir yaklaşım, aktif karbon veya alüminyum klorür gibi bir katalizör varlığında kükürt trioksit (SO₃) ile kükürt diklorür (SCl₂) arasındaki reaksiyonu içerir. Reaksiyon yüksek sıcaklıklarda, genellikle 300 ila 400 °C civarında gerçekleşir ve böylece tiyonil diklorür üretilir.
Başka bir yöntem, kükürt dioksitin (SO₂) fosfor pentaklorür (PCl₅) veya fosfor oksiklorür (POCl₃) ile doğrudan reaksiyonunu içerir. Bu reaksiyon, reaktiflerin aşamalı olarak eklenmesiyle geri akışta gerçekleşir ve tionil diklorüre yol açar.
Sülfürün fosfor triklorür (PCl₃) ile reaksiyonu tiyonil diklorürü verir. Bu işlem, reaktanların ısıtılmasını ve tiyonil diklorürün oluşmasına izin verilmesini içerir.
Başka bir yöntem, alüminyum klorür gibi bir Lewis asidi katalizörünün varlığında fosfor pentasülfit (P₂S₅) ile fosfor pentaklorür (PCl₅) arasındaki reaksiyonu içerir. Reaksiyon yüksek sıcaklıklarda meydana gelir ve tiyonil diklorürün oluşumuyla sonuçlanır.
Bu sentez yöntemlerinin, ilgili reaktiflerin tehlikeli doğasından dolayı uygun kullanım ve güvenlik önlemleri gerektirdiğini unutmamak önemlidir. Tiyonil diklorürün güvenli ve verimli sentezi, deneyimli kimyagerlerin uzmanlığını ve uygun laboratuvar ekipmanının kullanımını gerektirir.
Tiyonil Klorürün Kullanım Alanları
Tiyonil diklorür, çok yönlü kimyasal özelliklerinden dolayı çeşitli endüstrilerde geniş uygulama alanları bulmaktadır. Tiyonil diklorürün bazı yaygın kullanımları şunlardır:
- Karboksilik Asitlerin Dönüşümü: Tiyonil diklorür, organik sentezde büyük ölçüde Vilsmeier-Haack reaksiyonunu kullanarak karboksilik asitleri asil klorürlere dönüştürür.
- Alkol klorlama: Tiyonil diklorür alkollerle reaksiyona girerek alkil klorürler oluşturur ve Darzens reaksiyonu olarak bilinen, farmasötikler ve tarım kimyasalları için klorlu bileşiklerin üretiminde uygulama alanı bulur.
- Dehidrasyon maddesi: Tiyonil diklorür, dehidrasyon maddesi olarak görev yapar ve çeşitli bileşiklerin sudan uzaklaştırılmasını kolaylaştırır. Boyaların, parfümlerin ve farmasötik ara maddelerin sentezinde yaygın olarak kullanılır.
- Lityum-iyon pil üretimi: Üreticiler, yüksek enerji yoğunluğuna ve uzun raf ömrüne sahip lityum-tiyonil diklorür piller üretmek için tionil diklorür kullanıyor. Bu pillerin tıbbi cihazlarda, askeri ekipmanlarda ve uzaktan sensörlerde uygulamaları vardır.
- Polimerizasyon reaksiyonları: Tiyonil diklorür, polimerizasyon reaksiyonlarına katılarak, polikarbonatlar ve polianhidritler dahil olmak üzere çeşitli polimerlerin sentezine katkıda bulunur.
- Fosfor Bileşikleri: Tiyonil diklorür, fosfor triklorür gibi fosfor bileşikleriyle reaksiyona girerek fosforil klorürler üretir. Kimyacılar bu ara maddeleri organofosfat bileşiklerini ve alev geciktiricileri sentezlemek için kullanırlar.
- Kimyasal Reaktif: Tiyonil diklorür, esterifikasyon, halojenasyon ve nükleofilik ikame reaksiyonları dahil olmak üzere birçok kimyasal dönüşümde çok yönlü bir reaktif olarak hizmet eder.
Sorular:
S: Tiyonil klorürü neyle durulayabilirsiniz?
C: Tiyonil diklorür, büyük miktarda alkol veya metanol veya sodyum bikarbonat çözeltisi gibi uyumlu bir bazla durulanabilir.
S: Valerik asit ile tiyonil klorürün ürünü nedir?
C: Valerik asidin tiyonil diklorür ile reaksiyonu, valeril klorürün yanı sıra kükürt dioksit gazı üretir.
S: Tiyonil klorürü karboksilik asitle ekleyebilir misiniz?
C: Evet, Vilsmeier-Haack reaksiyonuyla karboksilik asitin asil klorüre dönüştürülmesi için tiyonil diklorür eklenebilir.
S: Tiyonil klorür (SOCl2) için doğru Lewis formülü aşağıdakilerden hangisidir?
C: Tiyonil diklorür (SOCl2) için doğru Lewis formülü S=O | Cl – Cl.
S: Tiyonil klorür reaksiyonunu yönlendiren şey nedir?
C: Tiyonil diklorür reaksiyonu, çeşitli kimyasal dönüşümlerde elektrofil görevi gören tiyonil klorürün yüksek reaktivitesi tarafından yönlendirilir.
S: Tiyonil klorür nasıl söndürülür?
C: Tiyonil diklorür, birincil veya ikincil alkol gibi uygun bir söndürme maddesinin eklenmesiyle veya su ile dikkatli bir şekilde hidrolize edilmesiyle söndürülebilir.
S: Aminleri tiyonil klorürle karıştırırsanız ne elde edersiniz?
C: Aminlerin tiyonil diklorürle karıştırılması, karşılık gelen amin hidroklorür tuzlarının oluşumuyla sonuçlanır.
S: Tiyonil klorür nedir?
C: Tiyonil diklorür, organik sentezde reaktif olarak ve dehidrasyon maddesi olarak yaygın olarak kullanılan, SOCl2 formülüne sahip kimyasal bir bileşiktir.
S: Tiyonil klorürün fazlası ne işe yarar?
C: Aşırı tiyonil diklorür şiddetli reaksiyonlara neden olabilir, muhtemelen zehirli gazların oluşmasına veya patlama tehlikesine neden olabilir ve dikkatli kullanılmalıdır.
S: Tiyonil klorür nasıl nötralize edilir?
C: Tiyonil diklorür, uygun güvenlik önlemleri alınarak sodyum bikarbonat veya sodyum hidroksit gibi uygun bir bazın büyük miktardaki fazlalığına dikkatli bir şekilde eklenerek nötrleştirilebilir.
