Demir(III) hidroksit, demirin su ile reaksiyonu sonucu oluşan bir bileşiktir. Farmasötiklerde, su arıtmada ve boyalarda pigment olarak yaygın olarak kullanılır.
| IUPAC Adı | Demir(III) hidroksit |
| Moleküler formül | Fe(OH)₃ |
| CAS numarası | 20344-49-4 |
| Eş anlamlı | Ferrik hidroksit, demir trihidroksit, ferrik hidrat, demir (III) oksihidroksit |
| InChI | InChI=1S/Fe.3H2O/h;3*1H2/q+3;;;/p-3 |
Demir (III) hidroksitin özellikleri
Demir(III) hidroksit formülü
Demir(III) hidroksitin formülü Fe(OH)₃’dur. Bu, her Fe(OH)₃ molekülünün üç OH iyonuna bağlı bir Fe atomundan oluştuğunu gösterir.
Demir(III) Hidroksit Molar Kütlesi
Fe(OH)₃’nın molar kütlesi, onu oluşturan elementlerin atomik kütleleri toplanarak hesaplanabilir. Demirin molar kütlesi 55.845 g/mol’dür ve her bir hidroksit (OH) iyonunun molar kütlesi 17.007 g/mol’dür. Bu nedenle Fe(OH)₃’nın molar kütlesi yaklaşık 106,867 g/mol’dür.
Demir (III) hidroksitin kaynama noktası
Fe(OH)₃ kaynama noktasına ulaşmadan ayrıştığı için iyi tanımlanmış bir kaynama noktasına sahip değildir. Bunun yerine ısıtıldığında demir(III) oksit ve su oluşturmak üzere termal ayrışmaya uğrar.
Demir (III) hidroksitin erime noktası
Fe(OH)₃ da ısıtıldığında ayrışır ve belirgin bir erime noktasına sahip değildir. Yüksek sıcaklıklarda demir(III) oksit ve suya dönüşür.
Demir (III) hidroksitin yoğunluğu g/mL
Fe(OH)₃’nın yoğunluğu, fiziksel durumu (katı veya çözelti) ve konsantrasyonu gibi çeşitli faktörlere bağlıdır. Katı bir Fe(OH)₃ formunun yoğunluğu yaklaşık 3,4 g/mL’dir.
Demir(III) Hidroksit Molekül Ağırlığı
Fe(OH)₃’nın moleküler ağırlığı, onu oluşturan atomların atom ağırlıkları toplanarak hesaplanır. Fe(OH)₃’nın moleküler ağırlığı yaklaşık 106.867 g/mol’dür.
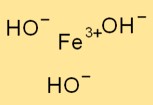
Demir (III) hidroksitin yapısı
Fe(OH)₃, bir demir atomunun üç hidroksit iyonu ile çevrelendiği trigonal bir yapıya sahiptir. Demir atomu merkezi atom görevi görür ve hidroksit iyonları ona iyonik bağlarla bağlanır.
Demir(III) hidroksitin çözünürlüğü
Fe(OH)₃’nun suda çözünürlüğü sınırlıdır. Suda çözündüğünde çökelti oluşturur ve çözünürlüğü sıcaklık, pH ve diğer iyonların varlığı gibi çeşitli faktörlere bağlıdır. Fe(OH)₃’nın çözünürlüğü asidik koşullar altında artar.
| Dış görünüş | Katı kahverengi |
| Spesifik yer çekimi | 3.4 |
| Renk | Kahverengi |
| Koku | Kokusuz |
| Molar kütle | 106.867 gr/mol |
| Yoğunluk | 3.4g/ml |
| Füzyon noktası | ayrıştırılmış |
| Kaynama noktası | ayrıştırılmış |
| Flaş noktası | Uygulanamaz |
| sudaki çözünürlük | Çözünmez |
| çözünürlük | Çözünmez. Sıcaklık, pH ve diğer iyonların varlığı gibi faktörlere bağlıdır |
| Buhar basıncı | İhmal edilebilir |
| Buhar yoğunluğu | Uygulanamaz |
| pKa | Uygulanamaz |
| pH | Yaklaşık 5-7 |
Demir(III) Hidroksit Güvenliği ve Tehlikeleri
Fe(OH)₃ belirli güvenlik hususlarını ve tehlikeleri beraberinde getirir. Genellikle düşük toksisiteye sahip olduğu kabul edilir. Ancak büyük miktarlarda yutulması veya solunması mide-bağırsak tahrişine ve solunum rahatsızlığına neden olabilir. Tahrişe neden olabileceğinden göz ve cilt ile temasından kaçınmak önemlidir. Temas halinde etkilenen bölgeleri bol su ile yıkayın. Fe(OH)₃ ile çalışırken, maruz kalma riskini en aza indirmek için eldiven ve gözlük gibi uygun koruyucu ekipmanların kullanılması tavsiye edilir. Toz birikmesini önlemek için yeterli havalandırma sağlanmalıdır. Ek olarak, potansiyel riskleri en aza indirmek için güvenlik önlemlerine uymak ve Fe(OH)₃’yu dikkatli bir şekilde kullanmak önemlidir.
| Tehlike sembolleri | Hiçbiri |
| Güvenlik Açıklaması | – Göz ve cilt ile temasından kaçının <br> – Koruyucu ekipman kullanın <br> – Yeterli havalandırma sağlayın |
| BM kimlik numaraları | Uygulanamaz |
| HS kodu | 2821.10.0000 |
| Tehlike sınıfı | sınıflandırılmamış |
| Paketleme grubu | Uygulanamaz |
| Toksisite | Düşük toksisite |
Demir (III) hidroksitin sentezi için yöntemler
Fe(OH)₃ sentezlemek için farklı yöntemler vardır. Yaygın olarak kullanılan bir yöntem, bir demir tuzu ile bir baz arasındaki çökeltme reaksiyonunu içerir. Örneğin, bir sodyum hidroksit (NaOH) çözeltisine bir demir klorür (FeCl₃) çözeltisi eklenerek Fe(OH)₃ oluşturulabilir. Reaksiyon şu şekilde gerçekleşir:
FeCl₃ + 3NaOH → Fe(OH)₃ + 3NaCl
Başka bir yöntemde demir(II) hidroksit, havaya maruz bırakılarak veya bir oksitleyici madde ile işlenerek Fe(OH)₃’ya oksitlenebilir. Reaksiyon şu şekilde gerçekleşir:
4Fe(OH)₂ + O₂ → 2Fe(OH)₃
Ek olarak Fe(OH)₃, bir demir tuzu çözeltisinin hidrolize edilmesiyle de hazırlanabilir. Bu işlem, demir tuzu çözeltisine su eklenmesini içerir ve bunun sonucunda Fe(OH)₃ çökeltisi oluşur. Reaksiyon şu şekilde gerçekleşir:
FeCl₃ + 3H₂O → Fe(OH)₃ + 3HCl
Bu sentez yöntemleri, farmasötikler, su arıtma ve boyalarda pigment olarak çeşitli uygulamalar için Fe(OH)₃ elde etmenin yollarını sağlar. Sentez işlemi sırasında uygun güvenlik önlemlerini takip etmek ve kimyasalları sorumlu bir şekilde kullanmak önemlidir.
Demir(III) Hidroksit Kullanımı
Fe(OH)₃ benzersiz özelliklerinden dolayı çeşitli uygulamalara sahiptir. Fe(OH)₃’nun bazı yaygın kullanımları şunlardır:
- İlaç endüstrisi: İlaç endüstrisi, demir eksikliği anemisini tedavi etmek için kullanılanlar gibi demir takviyeleri ve ilaçların üretiminde Fe(OH)₃ kullanır.
- Su Arıtma: Su arıtma proseslerinde kirleticileri ve safsızlıkları gidermek için Fe(OH)₃ kullanılır. Fe(OH)₃ topaklaştırıcı görevi görerek sudaki askıda kalan parçacıkların toplanmasına ve uzaklaştırılmasına yardımcı olur.
- Boyalarda pigment: Fe(OH)₃ kahverengi rengiyle boyalarda, kaplamalarda ve boyalarda pigment olarak uygulama alanı bulur. Bir dizi toprak tonu verir ve özellikle koyu sarı ve koyu sarı renklerin üretiminde kullanışlıdır.
- Atık Su Arıtma: Atık su arıtma tesisleri, endüstriyel atık sudan fosfatları ve ağır metal kirleticileri uzaklaştırmak için Fe(OH)₃ kullanır.
- Kataliz: Fe(OH)₃, hidrojen peroksitin ayrışması ve oksidasyon reaksiyonları dahil olmak üzere çeşitli kimyasal reaksiyonlarda katalizör görevi görür.
- Adsorban: Fe(OH)₃, çözeltilerden yabancı maddeleri, kirleticileri ve boyaları çıkarmak için adsorban malzeme görevi görür.
- Toprak iyileştirme: Fe(OH)₃ toprağın verimliliğini ve besin kullanılabilirliğini iyileştirmek için toprak iyileştirme görevi görür. Toprağın besin tutma kapasitesini artırır ve bitki büyümesi için gerekli demiri sağlar.
- Laboratuvar Reaktifi: Laboratuvarda araştırmacılar ve analistler, çökelme reaksiyonları ve pH ayarlaması da dahil olmak üzere çeşitli analitik ve araştırma amaçları için Fe(OH)₃’yı reaktif olarak kullanır.
Fe(OH)₃’nın çok yönlü uygulamaları, onun farklı endüstrilerdeki önemini ve farmasötiklerden çevre sanitasyonuna kadar çeşitli süreçlere katkısını vurgulamaktadır.
Sorular:
S: Demir(III) hidroksit formülü için doğru ağırlık nedir?
C: Fe(OH)₃ için doğru formül ağırlığı yaklaşık 106,867 g/mol’dür.
S: FeBr3 ile baryum hidroksit arasındaki reaksiyonun tam iyonik denklemi nedir?
C: FeBr3 ile baryum hidroksit arasındaki reaksiyonun tam iyonik denklemi FeBr₃ + 3Ba(OH)₂ → 3BaBr₂ + Fe(OH)₃ şeklindedir.
S: 75,0 mL’nin reaksiyona girmesiyle hangi kütlede demir(III) hidroksit çökeltisi üretilebilir?
C: Fe(OH)₃ çökeltisinin kütlesini belirlemek için reaktanların konsantrasyonu veya molaritesi gibi ek bilgiler gereklidir.
S: Demir(III) hidroksiti nasıl oluşturabilirim?
C: Fe(OH)₃, demir tuzları ve bazlar arasındaki çökeltme reaksiyonları, Fe(OH)2’nin oksidasyonu veya bir demir tuzu çözeltisinin hidrolizi dahil olmak üzere çeşitli yöntemlerle oluşturulabilir.
S: Demir(III) hidroksit çözünür mü?
C: Hayır, Fe(OH)₃ suda çözünmez. Suda çözündüğünde çökelti oluşturur.
S: 4,61 gram Fe³⁺’de kaç gram Fe(OH)₃ var?
C: Fe(OH)₃’nın gramını belirlemek için Fe³⁺’nin molar kütlesi ve reaksiyonun stokiyometrisi gereklidir.
S: Fe(OH)₃ ne renktir?
A: Fe(OH)₃ genellikle kahverengi renktedir.
Soru: Demir hidroksit katı mıdır?
C: Evet, demir hidroksit katı halde bulunur.
S: Termal olarak ayrışan demir hidroksit ne üretir?
C: Termal olarak ayrışmış Fe(OH)₃, demir(III) oksit (Fe₂O₃) ve su üretir.
Soru: Demir hidroksit suda çözünür mü?
C: Hayır, demir hidroksit suda çözünmez. Suyla karıştırıldığında çökelti oluşturur.
