2-Butanol, tatlı kokulu, renksiz, yanıcı bir sıvıdır. Genellikle çözücü olarak ve metil etil keton ve bütil asetat gibi kimyasalların üretiminde kullanılır.
| IUPAC Adı | 2-bütanol |
| Moleküler formül | C4H10O |
| CAS numarası | 78-92-2 |
| Eş anlamlı | Kuru-bütil alkol, 2-bütil alkol, bütan-2-ol, etilmetilkarbinol |
| InChI | InChI=1S/C4H10O/c1-3-4(2)5/h4-5H,3H2,1-2H3 |
2-bütanolün özellikleri
2-bütanol formülü
2-Butanol’ün kimyasal formülü C4H10O’dur; bu, dört karbon atomu, on hidrojen atomu ve bir oksijen atomu içerdiğini gösterir. Butanolün bir izomeridir ve CH3CH(OH)CH2CH3 yapısal formülüne sahiptir. Bileşik ismindeki “2”, hidroksil grubunun karbon zinciri üzerindeki konumunu belirtir.
2-Butanol Molar Kütle
C4H10O’nun molar kütlesi 74,12 g/mol’dür. Bu değer, bileşikteki tüm atomların karbon için 12,01 g/mol, hidrojen için 1,01 g/mol ve oksijen için 16,00 g/mol olan atomik kütlelerinin eklenmesiyle elde edilebilir. Molar kütle C4H10O’nun önemli bir özelliğidir çünkü kimyasal reaksiyonlarda gerekli bileşik miktarını hesaplamak için kullanılır.
2-bütanolün kaynama noktası
C4H10O’nun kaynama noktası standart basınçta (1 atm) 99,5 °C’dir (211,1 °F). Bu, bileşiğin sıvı halinin gaz haline dönüştüğü sıcaklıktır. C4H10O’nun kaynama noktası, hidrojen bağları ve molekül ağırlığından dolayı bütan (-0,5 °C) ve bütenden (-6,3 °C) daha yüksektir.
2-Butanol Erime Noktası
C4H10O’nun erime noktası -114,7 °C’dir (-174,5 °F). Bu, bileşiğin katı durumunun sıvı duruma geçtiği sıcaklıktır. C4H10O’nun erime noktası, dallanmış yapısı ve hidrojen bağlarından dolayı bütan (-138,4 °C) ve bütenden (-185,3 °C) daha düşüktür.
2-Butanol Yoğunluğu g/mL
C4H10O’nun yoğunluğu 25°C’de (77°F) 0,809 g/mL’dir. Bu değer, maddenin birim hacmi başına bileşiğin kütlesini gösterir. C4H10O’nun yoğunluğu, moleküler ağırlığı ve moleküller arası kuvvetler nedeniyle bütan (0,588 g/mL) ve bütenden (0,587 g/mL) daha yüksektir.
2-Butanol Molekül Ağırlığı
C4H10O’nun moleküler ağırlığı 74,12 g/mol’dür. Bir bileşiğin molekülündeki tüm atomların atom ağırlıklarının toplamıdır. Molekül ağırlığı, bileşiğin molar kütle, kaynama noktası ve yoğunluk gibi diğer özelliklerini hesaplamak için kullanılır.
2-bütanolün yapısı
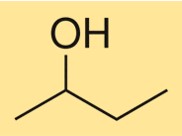
C4H10O’nun yapısı, ikinci karbon atomuna bir hidroksil grubunun bağlı olduğu dallanmış bir karbon zinciri ile karakterize edilir. Kiral merkezi olan birincil bir alkoldür, yani iki stereoizomer (R)-C4H10O ve (S)-C4H10O olarak bulunur. Bileşik, hidroksil grubu etrafındaki karbon ve oksijen atomlarının tetrahedral dizilimi nedeniyle üç boyutlu bir yapıya sahiptir.
2-bütanolün çözünürlüğü
C4H10O polar bir bileşiktir ve suda kısmen çözünür. C4H10O’nun sudaki çözünürlüğü 25°C’de (77°F) 80 g/L’dir. Bileşik etanol, eter ve aseton gibi organik çözücülerde daha fazla çözünür. C4H10O’nun çözünürlüğü sıcaklık, basınç ve çözücünün doğası gibi faktörlerden etkilenir.
| Dış görünüş | Temiz sıvı |
| Spesifik yer çekimi | 25°C’de (77°F) 0,810 g/mL |
| Renk | Renksiz |
| Koku | karakteristik |
| Molar kütle | 74,12 gr/mol |
| Yoğunluk | 25°C’de (77°F) 0,809 g/mL |
| Füzyon noktası | −114,7°C (−174,5°F) |
| Kaynama noktası | 1 atm basınçta 99,5°C (211,1°F) |
| Flaş noktası | 39°C (102°F) kapalı kap |
| sudaki çözünürlük | 25°C’de (77°F) 80 g/L |
| çözünürlük | Etanol, eter ve asetonda çözünür |
| Buhar basıncı | 25°C’de (77°F) 8,7 mmHg |
| Buhar yoğunluğu | 2,6 (hava = 1) |
| pKa | 16 |
| pH | 7.0-8.5 |
2-Butanolün güvenliği ve tehlikeleri
C4H10O, doğru şekilde kullanıldığında nispeten güvenli bir kimyasal olarak kabul edilir. Ancak yüksek konsantrasyonlara maruz kalmak gözlerde, ciltte ve solunum yollarında tahrişe neden olabilir. Ayrıca baş ağrısına, baş dönmesine ve mide bulantısına da neden olabilir. C4H10O’nun yutulması mide-bağırsak tahrişine ve olası merkezi sinir sistemi depresyonuna neden olabilir. Ayrıca C4H10O yanıcıdır ve yangın tehlikesi oluşturabilir. Ateş kaynaklarından uzakta, serin, kuru ve iyi havalandırılan bir yerde saklanmalıdır. Bu kimyasalla çalışırken eldiven ve gözlük gibi uygun kişisel koruyucu ekipmanlar giyilmelidir. Dökülmeler uygun prosedürler kullanılarak derhal temizlenmelidir.
| Tehlike sembolleri | F, Xi |
| Güvenlik Açıklaması | Isıdan/kıvılcımdan/açık alevden/sıcak yüzeylerden uzak tutun. Koruyucu eldiven/koruyucu kıyafet/göz koruyucu/yüz koruyucu kullanın. CİLT (veya saç) İLE TEMAS HALİNDE İSE: Kirlenmiş tüm giysileri derhal çıkarın. Cildi su/duş ile durulayın. SOLUNDUĞUNDA: Kazazedeyi temiz havaya çıkarın ve nefes alması kolay bir pozisyonda dinlenmesini sağlayın. YUTULMASI HALİNDE: Ağzınızı çalkalayın. Kusturmaya ÇALIŞMAYIN. Kendinizi iyi hissetmiyorsanız ZEHİR MERKEZİNİ veya doktoru arayın. |
| BM kimlik numaraları | UN1120 |
| HS kodu | 2905.13.00 |
| Tehlike sınıfı | 3 – Yanıcı sıvılar |
| Paketleme grubu | III |
| Toksisite | LD50 (oral, sıçan): 4,6 g/kg; LC50 (soluma, sıçan): 2.100 ppm/4 sa |
2-butanol sentezi için yöntemler
C4H10O’yu sentezlemek için çeşitli yöntemler kullanılabilir.
Bir yöntem, bir nikel veya paladyum katalizörünün varlığında sodyum borohidrit kullanılarak asetonun indirgenmesini içerir. Reaksiyon, fraksiyonel damıtma ile ayrılabilen bir C4H10O ve izomeri izobutanol karışımı üretir.
Başka bir yöntem, katalizör olarak sülfürik asit kullanılarak 1-butenin hidrasyonunu içerir. Reaksiyon, C4H10O ve izomerlerinin bir karışımını oluşturur, ancak istenen C4H10O, ayrımsal damıtma yoluyla ayrılabilir.
Reppe kimyası prosesi, asetileni formaldehit ve su ile reaksiyona sokmak için bir paladyum veya nikel katalizörünün kullanılmasını ve bunun sonucunda vinil alkol oluşumunu içerir. Bu reaksiyon ayrıca C4H10O sentezine yol açar. Vinil alkol daha sonra hidrojenasyona uğrayarak C4H10O oluşturur.
C4H10O’yu sentezlemenin başka bir yöntemi, bir nikel katalizörü varlığında krotonaldehitin hidrojenasyonunu içerir. Reaksiyon, C4H10O ve izomerinin bir karışımını üretir, ancak arzu edilen C4H10O, fraksiyonel damıtma yoluyla izole edilebilir.
2-bütanolün kullanım alanları
C4H10O’nun farklı endüstrilerde çeşitli uygulamaları vardır. Kullanımlarından bazıları şunlardır:
- Solvent: Reçine, vernik ve kaplama üretiminde solvent olarak kullanılır. Ayrıca selüloz eterleri ve esterleri için çözücü olarak da kullanılır.
- Yakıt: Düşük toksisitesi ve yüksek enerji içeriği nedeniyle biyoyakıt katkı maddesi olarak kullanılır. Etanolden daha yüksek yanma verimliliğine sahip olduğu gösterilmiştir ve benzine potansiyel bir alternatif olarak araştırılmaktadır.
- Kimyasal ara madde: metil etil keton, metil izobütil keton ve diizobütilen gibi diğer kimyasalların üretiminde hammadde olarak kullanılır.
- Parfüm ve Koku: Parfüm, sabun ve diğer kişisel bakım ürünlerinin üretiminde koku ve tatlandırıcı madde olarak kullanılır.
- Laboratuvar Reaktifi: Organik kimya deneylerinde solvent ve reaktif olarak kullanılır.
- Temizlik Maddesi: Endüstriyel ve ev temizlik ürünlerinde temizlik maddesi olarak kullanılır.
- Matbaa mürekkebi: Matbaa mürekkeplerinin üretiminde solvent olarak da kullanılır.
Sorular:
S: 2-butanol hazırlamak için hangi karbonil bileşiği ve Grignard reaktifi kullanılabilir?
C: C4H10O’yu hazırlamak için kullanılabilecek karbonil bileşiği bütanaldir (n-bütiraldehit olarak da bilinir) ve kullanılabilecek Grignard reaktifi etil magnezyum bromürdür. Bütanal ve etilmagnezyum bromür arasındaki reaksiyon, son ürün olarak C4H10O’yu üretir.
S: 2-butanol polar mıdır?
C: Evet, C4H10O kutupsaldır. Molekülün polar olmasını sağlayan polar fonksiyonel bir grup olan bir hidroksil grubu (-OH) içerir.
S: 2-butanol suda çözünür mü?
C: Evet, C4H10O suda kısmen çözünür. C4H10O’nun polar hidroksil grubu, su molekülleri ile hidrojen bağları oluşturmasına izin vererek suda bir miktar çözünür olmasını sağlar.
S: 2-bütanolün hidrojen bağı var mı?
C: Evet, C4H10O hidrojen bağları oluşturabilir. C4H10O’daki hidroksil grubu (-OH), su gibi hidrojen bağlanma yerleri içeren diğer polar moleküllerle hidrojen bağları oluşturabilir.
