Le thiosulfate de sodium pentahydraté (Na2S2O3 · 5H2O) est un composé cristallin qui se dissout facilement dans l’eau. Il est couramment utilisé dans le traitement photographique et comme antidote médical à l’empoisonnement au cyanure.
| Nom UICPA | Thiosulfate de sodium pentahydraté |
| Formule moléculaire | Na2S2O3 · 5H2O |
| Numero CAS | 10102-17-7 |
| Synonymes | Hyposulfite de sodium pentahydraté, Thiosulfate de sodium pentahydraté, Thiosulfate de sodium hydraté, Thiosulfate de sodium 5-hydraté |
| InChi | InChI=1S/2Na.H2O3S2.5H2O/c;;1-5(2,3)4;;;;;/h;;(H2,1,2,3,4);5 1H2/q2 +1; ;;;;;/p-2 |
Propriétés du thiosulfate de sodium pentahydraté
Formule pentahydratée de thiosulfate de sodium
La formule chimique du thiosulfate de sodium pentahydraté est Na2S2O3 · 5H2O. Il se compose de deux ions Na+, de deux ions (S2O3)2- et de cinq molécules d’eau. Le composé a un aspect cristallin blanc et est hautement soluble dans l’eau.
Thiosulfate De Sodium Pentahydraté Masse molaire
La masse molaire de Na2S2O3 · 5H2O est 248,18 g/mol. C’est la somme des masses atomiques de sodium, de soufre, d’oxygène et d’hydrogène dans le composé. La masse molaire est un paramètre important dans les calculs chimiques, notamment pour déterminer la quantité d’une substance nécessaire à une réaction.
Point d’ébullition du thiosulfate de sodium pentahydraté
Na2S2O3 · 5H2O n’a pas de point d’ébullition spécifique puisqu’il se décompose lorsqu’il est chauffé. Au lieu de cela, il subit un processus de décomposition thermique qui entraîne la libération de vapeur d’eau et de dioxyde de soufre. La température de décomposition de Na2S2O3 · 5H2O est d’environ 48°C.
Thiosulfate de sodium pentahydraté Point de fusion
Le point de fusion de Na2S2O3 · 5H2O est de 48,3°C. À cette température, le composé subit un changement de phase d’un solide à un liquide. Na2S2O3 · 5H2O a un point de fusion relativement bas, attribué à la présence de molécules d’eau dans sa structure cristalline.
Thiosulfate de sodium pentahydraté Densité g/mL
La densité de Na2S2O3 · 5H2O est de 1,67 g/mL. Le composé a une densité relativement élevée par rapport aux autres sels, ce qui est dû à la présence de plusieurs ions dans sa structure cristalline. La densité d’une substance est définie comme la quantité de masse par unité de volume.
Thiosulfate De Sodium Pentahydraté Poids moléculaire
Le poids moléculaire de Na2S2O3 · 5H2O est de 248,18 g/mol. C’est la somme des poids atomiques des éléments présents dans le composé. Le poids moléculaire est un paramètre important dans les calculs chimiques, notamment pour déterminer la stœchiométrie d’une réaction.
Structure pentahydratée du thiosulfate de sodium
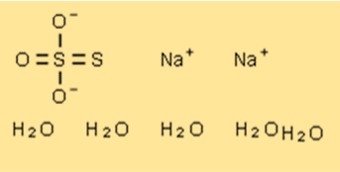
La structure cristalline de Na2S2O3 · 5H2O est composée de cations sodium, d’anions thiosulfate et de molécules d’eau. Les ions sodium sont situés aux coins de la cellule unitaire, tandis que les anions thiosulfate et les molécules d’eau sont disposés selon une structure en couches. Les anions thiosulfate et les molécules d’eau forment des chaînes qui s’étendent le long de l’axe c de la cellule unitaire.
Solubilité du thiosulfate de sodium pentahydraté
Na2S2O3 · 5H2O est hautement soluble dans l’eau. La solubilité d’une substance est définie comme la quantité maximale de substance pouvant être dissoute dans une quantité donnée de solvant à une température et une pression spécifiques. La solubilité du Na2S2O3 · 5H2O dans l’eau augmente avec la température et est utilisé dans diverses applications industrielles et médicales.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1,67 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 248,18 g/mole |
| Densité | 1,67 g/ml |
| Point de fusion | 48,3 °C |
| Point d’ébullition | Se décompose à 48°C |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans l’eau et le glycérol |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 7.2 |
| pH | 6,5-9,5 (solution à 5 % dans l’eau) |
Thiosulfate de sodium pentahydraté Sécurité et dangers
Na2S2O3 · 5H2O est généralement considéré comme sûr à manipuler et à utiliser. Cependant, il peut provoquer une irritation des yeux, de la peau et du système respiratoire. L’ingestion de grandes quantités de Na2S2O3 · 5H2O peut provoquer des troubles gastro-intestinaux. Il est également important d’éviter tout contact avec des agents oxydants et des acides forts, car ils pourraient réagir violemment avec ces substances. Na2S2O3 · 5H2O n’est pas considéré comme un risque d’incendie ou d’explosion, mais il peut émettre des fumées toxiques lorsqu’il est chauffé jusqu’à décomposition. Comme pour tous les produits chimiques, des précautions appropriées doivent être prises lors de la manipulation et de l’utilisation de Na2S2O3 · 5H2O afin de minimiser tout risque potentiel.
| Symboles de danger | Aucun |
| Description de la sécurité | S24/25 – Éviter tout contact avec la peau et les yeux |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 2832.10.00 |
| Classe de danger | Non classé comme dangereux selon le SGH |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | DL50 (orale, rat) : > 6 000 mg/kg |
Méthodes de synthèse du thiosulfate de sodium pentahydraté
Diverses méthodes peuvent synthétiser Na2S2O3 · 5H2O.
Une méthode courante implique la réaction du sulfite de sodium avec le soufre dans des conditions alcalines. Une autre méthode implique la réaction de l’hydroxyde de sodium avec du dioxyde de soufre, suivie de l’ajout de soufre. En chauffant le mélange, il produit Na2S2O3 · 5H2O.
Pour synthétiser Na2S2O3 · 5H2O, les chimistes font réagir le sulfure de sodium avec du dioxyde de soufre, entraînant la formation de sulfite de sodium. Oxydez ensuite le sulfite de sodium avec du peroxyde d’hydrogène ou du chlore pour former du sulfate de sodium. La réaction du soufre avec le sulfate de sodium a lieu dans des conditions alcalines et le mélange résultant est chauffé pour donner Na2S2O3 · 5H2O.
Il est important de noter que la synthèse de Na2S2O3 · 5H2O doit être effectuée avec des précautions de sécurité appropriées, telles que l’utilisation d’un équipement de protection et une ventilation adéquate. De plus, la pureté des matières premières et les conditions de réaction peuvent affecter le rendement et la pureté du produit final.
Utilisations du thiosulfate de sodium pentahydraté
Na2S2O3 · 5H2O a de nombreuses utilisations dans différentes industries en raison de ses propriétés uniques. Certaines de ses utilisations courantes incluent :
- Photographie : Il fonctionne activement comme un fixateur photographique pour éliminer les halogénures d’argent non exposés du film photographique.
- Médical : utilisé comme antidote à l’empoisonnement au cyanure, car il peut réagir avec le cyanure pour former le thiocyanate le moins toxique.
- Traitement de l’eau : Utilisé pour éliminer le chlore de l’eau, ce qui est important dans des industries telles que les piscines, les aquariums et le traitement des eaux usées.
- Chimie analytique : Utilisé comme agent réducteur dans les titrages et comme agent complexant dans la détermination des métaux lourds.
- Agriculture : Utilisé comme engrais pour corriger les carences en soufre des plantes.
- Industrie textile : Également utilisé comme agent de blanchiment pour les tissus en laine et en soie.
- Extraction de l’or : utilisé dans l’extraction de l’or pour extraire l’or des minerais par lixiviation.
- Autres utilisations : Couramment utilisé dans la production de papier, dans la fabrication de colorants et comme réactif de laboratoire.
Des questions:
Q : Combien de grammes de thiosulfate de sodium pentahydraté seraient nécessaires pour préparer 250,0 ml de 0,1000 M ?
R : Pour préparer 250,0 ml de solution 0,1000 M de Na2S2O3 · 5H2O, vous auriez besoin de 9,944 grammes de Na2S2O3 · 5H2O.
Q : Comment diluer le thiosulfate de sodium pentahydraté ?
R : Na2S2O3 · 5H2O peut être dilué en le dissolvant dans l’eau. La quantité d’eau nécessaire dépend de la concentration souhaitée de la solution.
Q : Combien de grammes de thiosulfate de sodium solide pentahydraté sont nécessaires pour préparer exactement ?
R : La quantité de solide Na2S2O3 · 5H2O nécessaire pour préparer une solution dépend de la concentration et du volume souhaités de la solution. Vous pouvez utiliser la formule C1V1 = C2V2, où C1 et V1 sont respectivement la concentration et le volume initiaux, et C2 et V2 sont respectivement la concentration et le volume finaux, pour calculer la quantité de solide requise.
Q : À quoi sert le thiosulfate de sodium pentahydraté ?
R : Na2S2O3 · 5H2O est utilisé dans la photographie, l’industrie médicale, le traitement de l’eau, la chimie analytique, l’agriculture, l’industrie textile, l’extraction de l’or, la production de papier, la fabrication de colorants et comme réactif de laboratoire.
Q : Qui vend du thiosulfate de sodium pentahydraté ?
R : Na2S2O3 · 5H2O est vendu par divers fournisseurs et distributeurs de produits chimiques, en ligne et hors ligne. Quelques exemples incluent Sigma-Aldrich, Fisher Scientific et VWR International.
Q : Que puis-je utiliser à la place de Na2S2O3·5H2O pour éteindre toute réaction ?
R : Il existe divers composés chimiques qui peuvent être utilisés comme alternative au Na2S2O3 · 5H2O pour les réactions de trempe, en fonction de la réaction spécifique et des exigences. Quelques exemples incluent l’urée, le chlorhydrate d’hydroxylamine et le bisulfite de sodium.
Q : Qu’est-ce que Na2S2O3·5H2O ?
R : Na2S2O3·5H2O est la formule chimique de Na2S2O3 · 5H2O, qui est un composé cristallin blanc utilisé dans diverses applications industrielles et de laboratoire.
