Le thiosulfate de sodium est un composé chimique de formule Na2S2O3. Il est couramment utilisé comme fixateur dans le traitement photographique et comme agent réducteur dans certaines réactions chimiques.
| Nom UICPA | Thiosulfate de sodium |
| Formule moléculaire | Na2S2O3 |
| Numero CAS | 7772-98-7 |
| Synonymes | Hyposulfite de sodium, thiosulfate de sodium, sel disodique de l’acide thiosulfurique, thiosulfate de sodium pentahydraté |
| InChI | InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
Propriétés du thiosulfate de sodium
Formule de thiosulfate de sodium
La formule chimique du thiosulfate de sodium est Na2S2O3. Il se compose de deux ions Na+ et de deux ions S2O3 2-. La formule montre les types et le nombre d’atomes présents dans une molécule du composé.
Thiosulfate De Sodium Masse molaire
La masse molaire de Na2S2O3 est de 158,11 g/mol. Il est calculé en additionnant les masses atomiques de tous les atomes présents dans une mole du composé. Cette valeur est utile pour déterminer la quantité de Na2S2O3 nécessaire pour une réaction spécifique ou pour calculer la concentration d’une solution.
Point d’ébullition du thiosulfate de sodium
Na2S2O3 n’a pas de point d’ébullition car il se décompose avant d’atteindre son point d’ébullition. À pression normale, il se décompose entre 48 et 55 °C, libérant du dioxyde de soufre. Cette propriété le rend impropre aux applications à haute température.
Thiosulfate de sodium Point de fusion
Le point de fusion du Na2S2O3 est de 48,3°C. C’est la température à laquelle le composé solide change d’état en liquide. Son point de fusion est relativement bas par rapport aux autres sels inorganiques, ce qui le rend facile à dissoudre dans l’eau.
Densité du thiosulfate de sodium g/mL
La densité de Na2S2O3 est de 1,667 g/mL. Cette valeur fait référence à la masse de la substance par unité de volume. Elle est supérieure à la densité de l’eau, ce qui signifie que Na2S2O3 coule dans l’eau.
Thiosulfate De Sodium Poids moléculaire
Le poids moléculaire de Na2S2O3 est de 158,11 g/mol. C’est la somme des poids atomiques de tous les atomes présents dans une molécule du composé. Le poids moléculaire est utile pour déterminer la quantité de Na2S2O3 nécessaire pour une réaction spécifique ou pour calculer la concentration d’une solution.
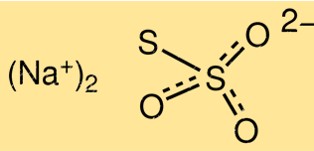
Structure du thiosulfate de sodium
La structure de Na2S2O3 est constituée de deux ions S2O3 2-, liés à un ion sodium, Na+. La molécule a une forme pyramidale trigonale avec un angle de liaison d’environ 103 degrés. L’ion thiosulfate a une liaison soufre-soufre et deux liaisons soufre-oxygène.
Solubilité du thiosulfate de sodium
Na2S2O3 est très soluble dans l’eau. La solubilité du Na2S2O3 dans l’eau augmente avec la température, environ 70 g du composé se dissolvant dans 100 ml d’eau à 25°C. Il est également soluble dans le glycérol et légèrement soluble dans l’alcool. Sa solubilité le rend utile dans diverses applications, telles que le traitement photographique et les traitements médicaux.
| Apparence | Poudre cristalline blanche |
| Gravité spécifique | 1,667 g/mL |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 158,11 g/mole |
| Densité | 1,667 g/mL |
| Point de fusion | 48,3 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble |
| Solubilité | Soluble dans le glycérol et légèrement soluble dans l’alcool |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | Neutre (pH 7) |
Sécurité et dangers du thiosulfate de sodium
Na2S2O3 est généralement considéré comme sûr lorsqu’il est manipulé correctement. Cependant, il peut être dangereux s’il est ingéré, inhalé ou s’il entre en contact avec les yeux ou la peau. Le composé peut provoquer une irritation de la peau et des yeux, et une exposition prolongée peut entraîner une dermatite. L’ingestion de Na2S2O3 peut provoquer des désagréments gastro-intestinaux, tels que des nausées et des vomissements. Il est important de porter un équipement de protection individuelle approprié, tel que des gants et des lunettes de sécurité, lorsque vous travaillez avec du Na2S2O3. En cas d’exposition, la zone affectée doit être rincée à l’eau et des soins médicaux doivent être recherchés si nécessaire.
| Symboles de danger | Aucun |
| Description de la sécurité | Evitez le contact avec les yeux, la peau et les vêtements. Ne pas ingérer. Porter un équipement de protection individuelle approprié. |
| Numéros d’identification de l’ONU | UN3077 |
| Code SH | 2832.3010.00 |
| Classe de danger | 9 |
| Groupe d’emballage | III |
| Toxicité | Faible toxicité ; La DL50 (orale, rat) est de 6 200 mg/kg |
Méthodes de synthèse du thiosulfate de sodium
Diverses méthodes peuvent synthétiser Na2S2O3.
Une méthode courante consiste à faire réagir du sulfite de sodium avec du soufre en présence d’une solution alcaline. Une autre méthode consiste à faire réagir du sulfite de sodium avec du dioxyde de soufre sous pression.
Une méthode pour préparer Na2S2O3 consiste à dissoudre le soufre dans une solution chaude de sulfite de sodium et d’hydroxyde de sodium . La solution refroidit et quelqu’un la filtre pour obtenir un produit solide.
Dans cette méthode, on fait réagir le dioxyde de soufre avec l’hydroxyde de sodium pour produire du sulfite de sodium, puis on le fait réagir avec du soufre élémentaire pour produire du Na2S2O3.
Pour produire du Na2S2O3, on peut réagir avec de l’acide sulfurique avec du sulfite de sodium, puis chauffer la solution obtenue et ajouter du soufre. Le sulfite de sodium va alors réagir avec le soufre pour former Na2S2O3.
Une autre méthode consiste à faire réagir de l’hydroxyde de sodium avec du soufre, suivie de l’ajout de sulfite de sodium pour former Na2S2O3.
Utilisations du thiosulfate de sodium
Na2S2O3 a un large éventail d’utilisations dans diverses industries et applications, notamment :
- Photographie : utilisé comme agent de fixation pour éliminer les halogénures d’argent non exposés des tirages et des films photographiques.
- Traitement de l’eau : Utilisé pour déchlorer l’eau en neutralisant le chlore et en prévenant ses effets nocifs sur la vie aquatique.
- Applications médicales : utilisé dans le traitement de l’empoisonnement au cyanure, car il réagit avec le cyanure pour former du thiocyanate, qui est moins toxique et peut être excrété par l’organisme.
- Applications industrielles : Utilisé comme agent réducteur dans les processus chimiques et comme conservateur dans les textiles, le cuir et le papier.
- Chimie analytique : utilisé comme titrant dans l’analyse de divers métaux, tels que le cuivre et l’arsenic.
- Industrie alimentaire et des boissons : utilisé comme conservateur alimentaire pour prévenir la décoloration et comme exhausteur de goût.
- Horticulture : Utilisé pour neutraliser les effets du chlore dans l’eau utilisée pour l’irrigation des plantes.
Des questions:
Q : À quoi sert le thiosulfate de sodium ?
R : Na2S2O3 a un large éventail d’applications, notamment la photographie, le traitement de l’eau, les traitements médicaux, les processus industriels, la chimie analytique, la conservation des aliments et des boissons et l’horticulture.
Q : Comment fabriquer du thiosulfate de sodium ?
R : Na2S2O3 peut être synthétisé en faisant réagir du sulfite de sodium avec du soufre ou du dioxyde de soufre en présence d’une solution alcaline. D’autres méthodes consistent à faire réagir de l’hydroxyde de sodium avec du soufre ou du dioxyde de soufre pour produire du sulfite de sodium, qui réagit ensuite avec du soufre pour produire du Na2S2O3.
Q : Qu’est-ce que le thiosulfate d’or et de sodium ?
R : L’or Na2S2O3 est un composé complexe formé par la réaction du chlorure d’or et du Na2S2O3. Il est utilisé en placage d’or et en chimie analytique pour détecter et quantifier l’or.
Q : Où acheter du thiosulfate de sodium ?
R : Na2S2O3 peut être acheté auprès de fournisseurs de produits chimiques, d’entreprises de fournitures de laboratoire et de détaillants en ligne.
Q : Où trouver du thiosulfate de sodium ?
R : Na2S2O3 peut être trouvé dans divers produits, notamment les produits chimiques photographiques, les produits de traitement de l’eau et les traitements médicaux.
Q : Quel est le nombre d’oxydation du soufre dans Na2S2O3 ?
R : Le nombre d’oxydation du soufre dans Na2S2O3 est de +2 dans l’ion thiosulfate (S2O3^2-) et de +6 dans l’ion sulfate (SO4^2-).
Q : Comment trouver le poids de Cu à partir du titrage de Na2S2O3 ?
R : Le poids de Cu peut être calculé à partir du volume et de la molarité de la solution Na2S2O3 utilisée dans le titrage, en utilisant l’équation chimique équilibrée pour la réaction entre Cu et Na2S2O3.
Q : Comment saurez-vous quand une quantité stoechiométrique de Na2S2O3 a été ajoutée ?
R : Une quantité stoechiométrique de Na2S2O3 a été ajoutée lorsque le point final de la réaction est atteint, comme indiqué par un changement de couleur ou une autre propriété physique ou chimique.
Q : Si 5 gouttes de 0,15 M de KI sont ajoutées à 40 gouttes de Na2S2O3, quelle est la concentration finale de KI ?
R : La concentration finale de KI ne peut être déterminée sans informations supplémentaires, telles que le volume ou la concentration de la solution Na2S2O3.
Q : Comment trouver la molarité de Na2S2O3 ?
R : La molarité de Na2S2O3 peut être calculée à partir de la masse de l’échantillon ainsi que du volume et de la concentration de la solution utilisée pour le dissoudre, en utilisant la formule Molarité = moles de soluté/volume de solution en litres.
