Le thiosulfate de potassium (K2S2O3) est un composé chimique utilisé en photographie, comme agent réducteur et pour neutraliser le chlore dans les piscines. Il a un aspect cristallin blanc et est soluble dans l’eau.
| Nom UICPA | Thiosulfate de potassium |
| Formule moléculaire | K2S2O3 |
| Numero CAS | 10294-66-3 |
| Synonymes | Hyposulfite de potassium, thiosulfate de potassium, thiosulfate de potassium pentahydraté, thiosulfate de potassium pentahydraté, sulfurothioate de potassium, acide sulfurothioique de potassium |
| InChI | InChI=1S/2K.H2O3S2/c;;1-4(2)3/h;;(H2,1,2,3)/q2*+1;/p-2 |
Propriétés du thiosulfate de potassium
Formule de thiosulfate de potassium
La formule chimique du thiosulfate de potassium (K2S2O3) indique le nombre et le type d’atomes présents dans le composé. La formule se compose de deux atomes de potassium, de deux atomes de soufre et de trois atomes d’oxygène. Les atomes de potassium ont une charge positive, tandis que les atomes de soufre et d’oxygène ont une charge négative.
Thiosulfate De Potassium Masse molaire
La masse molaire de K2S2O3 est de 190,33 g/mol. La masse molaire est la masse d’une mole d’une substance et est calculée en additionnant les masses atomiques de tous les atomes de la formule chimique. Dans le cas du K2S2O3, la formule se compose de deux atomes de potassium, de deux atomes de soufre et de trois atomes d’oxygène.
Point d’ébullition du thiosulfate de potassium
Le K2S2O3 n’a pas de point d’ébullition car il se décompose avant d’atteindre son point d’ébullition. La décomposition se produit lorsque la température atteint environ 100 °C et que du dioxyde de soufre est libéré. Par conséquent, le composé n’est généralement pas utilisé dans les applications à haute température.
Thiosulfate de Potassium Point de fusion
Le point de fusion du K2S2O3 est de 48,3 °C. Cette température est relativement basse par rapport aux autres composés chimiques. Lorsqu’il est chauffé à cette température, le solide K2S2O3 deviendra un liquide.
Densité du thiosulfate de potassium g/mL
La densité du K2S2O3 est de 1,667 g/mL. La densité est une mesure de la quantité de masse contenue dans un certain volume. Cette valeur signifie qu’un millilitre de K2S2O3 a une masse de 1,667 grammes.
Thiosulfate De Potassium Poids moléculaire
Le poids moléculaire du K2S2O3 est de 190,33 g/mol. Le poids moléculaire est la somme des poids atomiques de tous les atomes du composé. Il est souvent utilisé pour convertir entre les moles et les grammes d’une substance.
Structure du thiosulfate de potassium
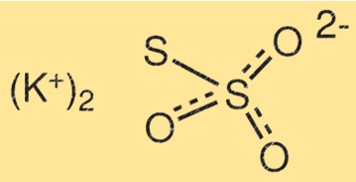
La structure du K2S2O3 se compose de deux atomes de potassium, de deux atomes de soufre et de trois atomes d’oxygène. Les atomes de soufre sont reliés les uns aux autres par une double liaison, tandis que l’autre atome de soufre est lié à l’un des atomes d’oxygène. Les atomes de potassium sont liés aux atomes d’oxygène restants.
Solubilité du thiosulfate de potassium
Le K2S2O3 est hautement soluble dans l’eau, avec une solubilité de 432 g/L à 20 °C. Cela en fait un composé efficace pour le traitement de l’eau et comme agent de fixation photographique. Cependant, il n’est pas soluble dans les solvants organiques tels que l’éthanol ou l’acétone.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 1.667 |
| Couleur | Incolore à blanc |
| Odeur | Inodore |
| Masse molaire | 190,33 g/mole |
| Densité | 1,667 g/mL |
| Point de fusion | 48,3 °C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Très soluble (432 g/L à 20 °C) |
| Solubilité | Insoluble dans les solvants organiques |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | N’est pas applicable |
| pH | 6,0 – 9,0 (solution aqueuse à 5 %) |
Sécurité et dangers du thiosulfate de potassium
Le K2S2O3 est généralement considéré comme étant sûr à manipuler et à utiliser lorsque les précautions appropriées sont prises. Il est toutefois important d’être conscient de certains dangers potentiels associés à ce composé. L’exposition à la poussière ou aux vapeurs de K2S2O3 peut provoquer une irritation des yeux, de la peau et du système respiratoire. L’ingestion du composé peut également provoquer des nausées, des vomissements et de la diarrhée. De plus, le contact avec le composé peut provoquer une dermatite ou une sensibilisation cutanée chez certaines personnes. Comme pour tout produit chimique, il est important de suivre les protocoles de sécurité appropriés lors de la manipulation du K2S2O3 afin d’éviter toute exposition et de réduire le risque d’accident.
| Symboles de danger | XI |
| Description de la sécurité | S22 – Ne pas respirer les poussières. S24/25 – Éviter tout contact avec la peau et les yeux. S37/39 – Porter des gants appropriés et une protection des yeux/du visage. |
| Numéros d’identification de l’ONU | ONU 3077 |
| Code SH | 2832.10.00 |
| Classe de danger | 9 – Matières dangereuses diverses |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) : 2 500 mg/kg |
Méthodes de synthèse du thiosulfate de potassium
On peut synthétiser le K2S2O3 par diverses méthodes, notamment la réaction du soufre avec du sulfite de potassium en présence d’un hydroxyde de métal alcalin.
Une autre méthode implique la réaction de l’hydroxyde de potassium avec du soufre et du dioxyde de soufre gazeux. Cette réaction produit du K2S2O3 et du sulfate de potassium comme sous-produits.
Une méthode de synthèse alternative implique la réaction du sulfite de potassium avec du thiosulfate de sodium dans une solution aqueuse. On peut filtrer et laver le précipité résultant pour obtenir du K2S2O3 pur.
Pour préparer le K2S2O3 en laboratoire, on peut faire réagir de l’hydroxyde de potassium avec du soufre, puis ajouter du dioxyde de soufre gazeux au mélange. Le produit résultant est un solide cristallin blanc qui peut être davantage purifié par recristallisation.
Utilisations du thiosulfate de potassium
Le K2S2O3 a plusieurs utilisations importantes dans diverses industries. Voici quelques-unes de ses applications les plus courantes :
- Photographie : le thiosulfate de potassium est utilisé comme agent fixateur dans le traitement photographique pour éliminer les halogénures d’argent inutilisés et empêcher la décoloration de l’image.
- Agriculture : le thiosulfate de potassium est utilisé comme engrais pour fournir aux plantes du soufre et du potassium, qui sont des nutriments importants pour la croissance et le développement.
- Traitement de l’eau : le thiosulfate de potassium est utilisé pour éliminer le chlore de l’eau des piscines et des spas, ainsi que pour neutraliser les effets du chlore dans le traitement des eaux usées industrielles.
- Chimie analytique : le thiosulfate de potassium est utilisé en chimie analytique comme agent réducteur pour déterminer la concentration d’iode et d’autres agents oxydants.
- Traitements médicaux : le thiosulfate de potassium a été utilisé dans certains traitements médicaux, comme le traitement de l’empoisonnement au cyanure.
- Applications industrielles : le thiosulfate de potassium est utilisé dans diverses applications industrielles, telles que la galvanoplastie, le tannage du cuir et l’extraction d’huile.
Des questions:
Q : Comment déterminer si quelque chose est un agent réducteur du thiosulfate de potassium ?
R : K2S2O3 est un agent réducteur car il a la capacité de donner des électrons à d’autres molécules ou ions, ce qui réduit leur état d’oxydation.
Q : Qu’est-ce qui fait du thiosulfate de potassium un agent réducteur ?
R : K2S2O3 possède un atome de soufre avec un état d’oxydation inférieur à celui du sulfate, ce qui lui permet de donner des électrons à d’autres molécules ou ions et d’agir comme agent réducteur.
Q : Le thiosulfate de potassium brûle-t-il les légumes verts ?
R : Non, K2S2O3 ne brûle pas les verts. Il s’agit d’un solide cristallin blanc et ne présente aucune coloration verte.
Q : Quelle est la solubilité molaire de AgCl dans 1,0 M de K2S2O3 ?
R : La solubilité molaire de AgCl dans 1,0 M K2S2O3 dépend de divers facteurs tels que la température et la force ionique. Une valeur précise ne peut être déterminée sans informations supplémentaires.
Q : Quel est le nombre de charge ou d’oxydation du K dans 2 (K2S2O3) ?
R : Le nombre de charge ou d’oxydation de K dans 2 (K2S2O3) est +1.
Q : Quel est l’état d’oxydation du S dans K2S2O3 ?
R : L’état d’oxydation de S dans K2S2O3 est +2.
Q : Combien de molécules y a-t-il dans 4 moles de K2S2O3 ?
R : Il y a environ 4 x 6,022 x 10^23 molécules de K2S2O3 dans 4 moles de K2S2O3, ce qui équivaut à 2,409 x 10^24 molécules.
Q : Combien représentent 4 moles de K2S2O3 ?
R : La masse de 4 moles de K2S2O3 peut être calculée en multipliant la masse molaire de K2S2O3 (190,31 g/mol) par 4, ce qui équivaut à 761,24 grammes. Par conséquent, 4 moles de K2S2O3 équivalent à 761,24 grammes.
