Le thiosulfate de calcium (CaO3S2) est un composé composé de calcium, d’oxygène et de soufre. Il est couramment utilisé dans les industries médicales et agricoles comme engrais et comme traitement pour certaines conditions médicales.
| Nom UICPA | Thiosulfate de calcium |
| Formule moléculaire | CaO3S2 |
| Numero CAS | 10124-41-1 |
| Synonymes | Hyposulfite de calcium ; Thiosulfate de calcium ; Sulfhydrate de calcium ; Thiosulfonate de calcium |
| InChI | InChI=1S/Ca.H2O3S2/c;1-4(2)3/h;(H2,1,2,3)/q+2;/p-2 |
Propriétés du thiosulfate de calcium
Formule de thiosulfate de calcium
La formule chimique du thiosulfate de calcium est CaS2O3. Il indique le type et le nombre d’atomes dans une molécule. La formule peut être utilisée pour déterminer la masse molaire et d’autres propriétés du composé.
Thiosulfate De Calcium Masse molaire
La masse molaire de CaO3S2 est de 152,18 g/mol. Il est composé d’un atome de calcium, de trois atomes d’oxygène et de deux atomes de soufre. La masse molaire est une propriété importante utilisée dans les calculs chimiques, par exemple pour déterminer la quantité d’une substance nécessaire pour produire une certaine réaction.
Point d’ébullition du thiosulfate de calcium
Le CaO3S2 n’a pas de point d’ébullition défini car il se décompose avant d’être bouilli. Il commence à se décomposer vers 75°C et libère du dioxyde de soufre. Le point d’ébullition d’une substance est la température à laquelle elle passe d’un liquide à un gaz à une certaine pression.
Thiosulfate de calcium Point de fusion
Le point de fusion du CaO3S2 est de 155°C. À cette température, le composé solide passe de l’état solide à l’état liquide. Le point de fusion est une propriété importante utilisée pour identifier et classer les substances.
Densité du thiosulfate de calcium g/mL
La densité de CaO3S2 est de 2,67 g/mL. La densité est la quantité de masse par unité de volume. La densité d’une substance peut être utilisée pour déterminer si elle flottera ou coulera dans une autre substance, comme l’eau.
Thiosulfate De Calcium Poids moléculaire
Le poids moléculaire du CaO3S2 est de 152,18 g/mol. C’est la somme des poids atomiques de tous les atomes d’une molécule. Le poids moléculaire est utilisé pour calculer diverses propriétés d’une substance, telles que sa molarité ou sa concentration.
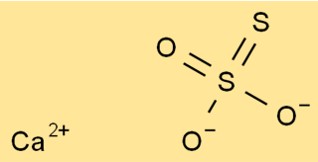
Structure du thiosulfate de calcium
La structure de CaO3S2 est composée d’un ion Ca2+ et d’un ion S2O32-. L’ion thiosulfate possède un atome de soufre central auquel sont liés quatre atomes d’oxygène. Deux des atomes d’oxygène sont à double liaison et deux à simple liaison.
Solubilité du thiosulfate de calcium
Le CaO3S2 est légèrement soluble dans l’eau, avec une solubilité d’environ 16 g/L à température ambiante. Il est plus soluble dans l’eau chaude que dans l’eau froide. La solubilité est la quantité maximale d’une substance pouvant se dissoudre dans un solvant donné à une température et une pression spécifiques.
| Apparence | Solide cristallin blanc |
| Gravité spécifique | 2,67 g/ml |
| Couleur | Blanc |
| Odeur | Inodore |
| Masse molaire | 152,18 g/mole |
| Densité | 2,67 g/ml |
| Point de fusion | 155°C |
| Point d’ébullition | Se décompose avant de bouillir |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | 16 g/L à température ambiante |
| Solubilité | Légèrement soluble dans l’eau |
| Pression de vapeur | N’est pas applicable |
| Densité de vapeur | N’est pas applicable |
| pKa | 7.2 (dissociation de l’acide thiosulfurique) |
| pH | 6,0-8,5 (solution aqueuse à 1 %) |
Sécurité et dangers du thiosulfate de calcium
Le CaO3S2 est généralement considéré comme sûr lorsqu’il est manipulé et utilisé de manière appropriée. Cependant, il peut provoquer une irritation de la peau et des yeux ainsi qu’une détresse respiratoire en cas d’inhalation. Il peut également provoquer une irritation gastro-intestinale en cas d’ingestion. Lors de la manipulation de ce composé, il est important de porter un équipement de protection individuelle approprié, tel que des gants et des lunettes de protection. En cas de contact avec la peau, il doit être lavé abondamment à l’eau. En cas de contact avec les yeux, rincer à l’eau pendant au moins 15 minutes. En cas d’ingestion ou d’inhalation, consulter immédiatement un médecin. Le CaO3S2 doit être stocké dans un endroit frais, sec et bien ventilé, à l’écart des matériaux incompatibles.
| Symboles de danger | Xi (Irritant) |
| Description de la sécurité | Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. |
| Numéros d’identification de l’ONU | Non réglementé |
| Code SH | 2832.10.00 |
| Classe de danger | 6.1 (toxique) |
| Groupe d’emballage | III |
| Toxicité | DL50 (orale, rat) 1 064 mg/kg ; CL50 (inhalation, rat) >2 000 mg/m3 |
Méthodes de synthèse du thiosulfate de calcium
Diverses méthodes existent pour synthétiser le CaO3S2.
Une méthode consiste à faire réagir l’hydroxyde de calcium (Ca(OH)2) avec Na2S2O3 dans l’eau pour produire du CaO3S2 et de l’hydroxyde de sodium (NaOH).
Une autre méthode consiste à faire réagir le sulfate de calcium (CaSO4) avec le sulfite de sodium (Na2SO3) et le soufre (S) dans l’eau pour produire du CaO3S2 et du sulfate de sodium (Na2SO4).
On peut obtenir du CaO3S2 en faisant réagir le soufre (S) et l’oxygène (O2) avec de l’oxyde de calcium (CaO) ou du carbonate de calcium (CaCO3) dans l’eau. Cette méthode produit du CaO3S2, du sulfate de calcium (CaSO4) et du dioxyde de carbone (CO2) comme sous-produits.
Pour synthétiser du CaO3S2, on peut faire réagir Na2S2O3 avec du chlorure de calcium (CaCl2) dans l’eau. Cette méthode produit du CaO3S2 et du chlorure de sodium (NaCl) comme sous-produits.
Une autre méthode consiste à faire réagir l’hydroxyde de calcium (Ca(OH)2) avec du dioxyde de soufre (SO2) et de l’oxygène (O2) dans l’eau pour produire du CaO3S2 et du sulfite de calcium (CaSO3) comme sous-produits.
Utilisations du thiosulfate de calcium
Le CaO3S2 a diverses utilisations dans différentes industries. Certaines de ses utilisations incluent :
- Agriculture – Utilisé comme engrais pour fournir du calcium et du soufre aux plantes.
- Photographie – Utilisé comme agent de fixation dans le traitement photographique pour éliminer l’excès d’halogénure d’argent des tirages et des négatifs.
- Traitement de l’eau – Utilisé pour éliminer le chlore de l’eau et neutraliser le chlore dans les eaux usées.
- Médecine – Utilisé comme traitement en cas d’empoisonnement au cyanure, car il réagit avec le cyanure pour former le thiocyanate le moins toxique.
- Industriel – Utilisé dans divers processus industriels, tels que la fabrication de pâtes et papiers, le raffinage du pétrole et la transformation des textiles.
- Industrie alimentaire – Utilisé comme conservateur alimentaire pour empêcher la croissance des bactéries et maintenir la fraîcheur des aliments.
- Santé animale – Utilisé comme complément nutritionnel pour les animaux pour leur apporter du calcium et du soufre.
- Cosmétiques – Utilisé dans les cosmétiques comme agent revitalisant capillaire et comme hydratant pour la peau.
Des questions:
Q : Qu’est-ce qui est le plus soluble dans l’eau, le thiosulfate de calcium ou le thiosulfate de strontium ?
R : Le CaO3S2 est plus soluble dans l’eau que le thiosulfate de strontium.
Q : Selon vous, lequel serait le plus soluble dans l’eau, le thiosulfate de strontium ou le thiosulfate de calcium ?
R : Le CaO3S2 devrait être plus soluble dans l’eau que le thiosulfate de strontium.
Q : Qu’est-ce qui constitue un atome de déchloration au thiosulfate de calcium ?
R : Un atome de déchloration CaO3S2 se compose d’un atome de calcium, de trois atomes d’oxygène, de deux atomes de soufre et de deux ions thiosulfate.
Q : Comment identifier le thiosulfate de calcium ?
R : Le CaO3S2 peut être identifié grâce à ses propriétés physiques et chimiques, ainsi que grâce à diverses techniques analytiques, telles que la spectroscopie infrarouge et la diffraction des rayons X.
Q : Que signifient les chiffres dans le thiosulfate de calcium ?
R : Les nombres dans CaO3S2 font référence au nombre d’atomes de chaque élément présent dans le composé. Par exemple, CaO3S2 indique qu’il existe un atome de calcium, trois atomes d’oxygène et deux atomes de soufre.
Q : Qu’est-ce que le traitement de l’eau au thiosulfate de calcium ?
R : Le CaO3S2 est utilisé dans le traitement de l’eau pour éliminer le chlore de l’eau et neutraliser le chlore dans les eaux usées.
Q : Existe-t-il des comprimés de thiosulfate de calcium ?
R : Oui, les comprimés de CaO3S2 sont disponibles comme complément nutritionnel pour les animaux, leur apportant du calcium et du soufre.
