Le tétrachlorure de carbone est un liquide incolore à l’odeur sucrée. Il était couramment utilisé comme solvant, mais sa production et son utilisation ont diminué en raison de ses effets nocifs sur la santé et l’environnement.
| Nom UICPA | Tétrachlorométhane |
| Formule moléculaire | CCl4 |
| Numero CAS | 56-23-5 |
| Synonymes | Carbone tet, Tétraforme, Perchlorométhane, Tétrasol |
| InChI | InChI=1S/CCl4/c2-1(3,4)5 |
Propriétés du tétrachlorure de carbone
Formule de tétrachlorure de carbone
La formule chimique du tétrachlorure de carbone est CCl4. Il représente une molécule composée d’un atome de carbone lié à quatre atomes de chlore. La formule fournit des informations essentielles sur la composition élémentaire et la disposition des atomes au sein du composé.
Tétrachlorure De Carbone Masse molaire
La masse molaire du tétrachlorométhane est calculée en additionnant les masses atomiques de ses éléments constitutifs. Le carbone a une masse molaire de 12,01 g/mol, tandis que le chlore a une masse molaire de 35,45 g/mol. En additionnant ces valeurs, la masse molaire du tétrachlorométhane est d’environ 153,82 g/mol.
Point d’ébullition du tétrachlorure de carbone
Le tétrachlorométhane a un point d’ébullition relativement élevé de 76,72°C (170,1°F). Cela signifie qu’à pression atmosphérique standard, le composé se transforme d’un liquide en gaz à cette température. Le point d’ébullition reflète la force des forces intermoléculaires au sein de la substance.
Tétrachlorure de carbone Point de fusion
Le point de fusion du tétrachlorométhane est de -22,92°C (-9,26°F). C’est la température à laquelle la forme solide du composé se transforme en liquide. Le point de fusion donne un aperçu de la force des liaisons qui maintiennent les atomes ensemble au sein du réseau cristallin.
Densité du tétrachlorure de carbone g/mL
La densité du tétrachlorométhane est d’environ 1,586 g/mL. La densité fait référence à la masse d’une substance par unité de volume. La densité du tétrachlorométhane indique qu’il est plus dense que l’eau, qui a une densité de 1 g/mL.
Carbone Tétrachlorure Poids moléculaire
Le poids moléculaire du tétrachlorométhane est calculé en additionnant les poids atomiques de ses atomes constitutifs. Avec un atome de carbone (12,01 g/mol) et quatre atomes de chlore (35,45 g/mol chacun), le poids moléculaire du tétrachlorométhane est d’environ 153,82 g/mol.
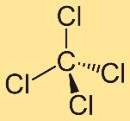
Structure du tétrachlorure de carbone
La structure du tétrachlorométhane est constituée d’un atome de carbone central lié à quatre atomes de chlore. Ces atomes de chlore sont positionnés symétriquement autour de l’atome de carbone, formant une géométrie tétraédrique. Cette structure contribue aux propriétés et au comportement du composé.
Solubilité du tétrachlorure de carbone
Le tétrachlorométhane est peu soluble dans l’eau, avec une solubilité d’environ 0,8 g/L à 20°C. Cependant, il présente une solubilité plus élevée dans les solvants organiques tels que l’éthanol, l’éther et le benzène. Les caractéristiques de solubilité sont influencées par les forces intermoléculaires et la polarité des substances impliquées.
| Apparence | Liquide incolore |
| Gravité spécifique | 1.586 |
| Couleur | N / A |
| Odeur | Doux |
| Masse molaire | 153,82 g/mole |
| Densité | 1,586 g/mL |
| Point de fusion | -22,92°C (-9,26°F) |
| Point d’ébullition | 76,72°C (170,1°F) |
| Point d’éclair | N / A |
| Solubilité dans l’eau | 0,8 g/L à 20°C |
| Solubilité | Soluble dans les solvants organiques tels que l’éthanol, l’éther et le benzène |
| Pression de vapeur | 11,9 mmHg à 20°C |
| Densité de vapeur | 5,3 (air = 1) |
| pKa | N / A |
| pH | N / A |
Sécurité et dangers du tétrachlorure de carbone
Le tétrachlorométhane présente des risques importants pour la sécurité. Il est considéré comme hautement toxique et peut nuire gravement à la santé humaine. L’inhalation de ses vapeurs peut entraîner une irritation respiratoire, des étourdissements, des nausées et même des lésions hépatiques et rénales. Le contact de la peau avec le liquide peut provoquer des brûlures et des irritations. Le composé est également un cancérigène connu, posant des risques pour la santé à long terme. De plus, le tétrachlorométhane est dangereux pour l’environnement, avec le potentiel de contaminer le sol et l’eau. En raison de ces dangers, sa production et son utilisation ont été considérablement restreintes afin de minimiser l’exposition et de protéger à la fois la santé humaine et l’environnement. Des protocoles appropriés de manipulation, de stockage et d’élimination doivent être suivis pour atténuer les risques associés au tétrachlorométhane.
| Symboles de danger | T, Xn |
| Description de la sécurité | Très toxique ; Nocif |
| Numéros d’identification de l’ONU | ONU 1846 |
| Code SH | 2903.14.0000 |
| Classe de danger | 6.1 (Substances toxiques) |
| Groupe d’emballage | II |
| Toxicité | Toxicité aiguë, Cancérogène |
Méthodes de synthèse du tétrachlorure de carbone
Le tétrachlorométhane peut être synthétisé par différentes méthodes. Une méthode courante implique la réaction entre le chlore gazeux (Cl2) et le disulfure de carbone (CS2) en présence d’un catalyseur tel que le chlorure d’aluminium (AlCl3).
Dans ce processus, le chlore gazeux réagit avec la vapeur de disulfure de carbone pour produire du tétrachlorométhane et du soufre. La réaction se déroule comme suit :
Cl2 + CS2 → CCl4 + S
Une autre méthode implique la réaction entre le méthane (CH4) et le chlore gazeux. Dans des conditions contrôlées, le méthane réagit avec le chlore en présence de lumière ultraviolette (UV) ou de chaleur pour produire du tétrachlorométhane et du chlorure d’hydrogène. La réaction se déroule comme suit :
CH4 + 4Cl2 → CCl4 + 4HCl
La chloration du disulfure de carbone en utilisant du chlorure d’hydrogène (HCl) comme agent de chloration produit du tétrachlorométhane. Cette réaction nécessite un catalyseur, tel que le chlorure de fer (III) (FeCl3). La réaction se déroule comme suit :
CS2 + 3HCl + FeCl3 → CCl4 + S + 2FeCl2
Lors de la synthèse du tétrachlorométhane, les individus doivent faire preuve de prudence en raison de la nature dangereuse du composé. Ils doivent utiliser des mesures de sécurité strictes et des équipements appropriés pour assurer leur bien-être et prévenir la contamination de l’environnement.
Utilisations du tétrachlorure de carbone
Diverses applications ont utilisé les propriétés uniques du tétrachlorométhane. Voici quelques-unes de ses utilisations :
- Solvant : Le tétrachlorométhane dissolvait autrefois les huiles, les graisses, le caoutchouc et les cires, servant de solvant. Cependant, sa toxicité et ses préoccupations environnementales ont considérablement réduit son utilisation de solvants.
- Extincteur : Le tétrachlorométhane éteignait autrefois certains types d’incendies impliquant des équipements électriques et des liquides inflammables. Des alternatives plus sûres et leurs effets nocifs ont conduit à l’abandon progressif de son utilisation.
- Intermédiaire chimique : le tétrachlorométhane a joué un rôle d’intermédiaire chimique dans la production de divers composés, tels que les réfrigérants, les pesticides et les produits pharmaceutiques.
- Agent de nettoyage : les industries utilisaient auparavant le tétrachlorométhane comme agent de nettoyage pour les surfaces métalliques et les composants électroniques. Cependant, les risques sanitaires et environnementaux ont incité à préférer des alternatives plus sûres.
- Réactif de laboratoire : Le tétrachlorométhane sert parfois de réactif ou de solvant pour des réactions et extractions spécifiques en laboratoire. Les chimistes préfèrent généralement des alternatives plus sûres et en limitent l’utilisation.
Il est essentiel de noter que bon nombre de ces applications ont diminué, voire complètement cessé, en raison des effets nocifs du tétrachlorométhane sur la santé humaine et l’environnement. Par conséquent, l’utilisation du tétrachlorométhane a considérablement diminué et des substances alternatives moins toxiques et moins impactantes sur l’environnement ont été adoptées dans diverses industries.
Des questions:
Q : Pouvez-vous toujours acheter des substituts au tétrachlorure de carbone ?
R : Oui, il existe des substituts au tétrachlorométhane qui sont plus sûrs et ont un impact environnemental moindre.
Q : Pouvez-vous toujours acheter du tétrachlorure de carbone ?
R : Le tétrachlorométhane est restreint dans de nombreux pays en raison de sa toxicité et de ses risques environnementaux, sa disponibilité à l’achat est donc limitée.
Q : Le tétrachlorure de carbone est-il légal ?
R : Le tétrachlorométhane est soumis à des restrictions légales dans de nombreux pays en raison de ses effets nocifs sur la santé et l’environnement.
Q : Le tétrachlorure de carbone est-il un alcalin ou un acide ?
R : Le tétrachlorométhane n’est ni alcalin ni acide ; c’est un composé neutre.
Q : Le tétrachlorure de carbone est-il polaire ou non polaire ?
R : Le tétrachlorométhane est une molécule non polaire en raison de sa structure tétraédrique symétrique, ce qui entraîne un partage égal des électrons.
Q : Quelle est la masse molaire du tétrachlorure de carbone ?
R : La masse molaire du tétrachlorométhane est d’environ 153,82 g/mol.
Q : Qu’est-ce que le tétrachlorure de carbone ?
R : Le tétrachlorométhane est un composé liquide incolore principalement utilisé comme solvant dans le passé, mais son utilisation est désormais limitée en raison de sa toxicité et de ses préoccupations environnementales.
Q : Quelle est la formule chimique du tétrachlorure de carbone ?
R : La formule chimique du tétrachlorométhane est CCl4.
Q : La liaison dans le tétrachlorure de carbone est-elle ?
R : La liaison dans le tétrachlorométhane est covalente, avec quatre liaisons covalentes entre l’atome de carbone central et les atomes de chlore environnants.
Q : Le tétrachlorure de carbone est-il ionique ou covalent ?
R : Le tétrachlorométhane est un composé covalent, car il forme des liaisons en partageant des électrons entre les atomes de carbone et de chlore.
Q : Combien d’atomes de chlore y a-t-il dans la molécule de tétrachlorure de carbone ?
R : Il y a quatre atomes de chlore dans la molécule de tétrachlorométhane.
Q : Pour chaque soluté, identifiez le meilleur solvant : eau ou tétrachlorure de carbone ?
R : Le meilleur solvant dépend du soluté. L’eau est généralement un meilleur solvant pour les substances polaires, tandis que le tétrachlorométhane est meilleur pour les substances non polaires.
Q : Structure de Lewis du tétrachlorométhane ?
R : Dans la structure de Lewis du tétrachlorométhane, l’atome de carbone central est lié à quatre atomes de chlore, sans paires libres sur l’atome de carbone central.
