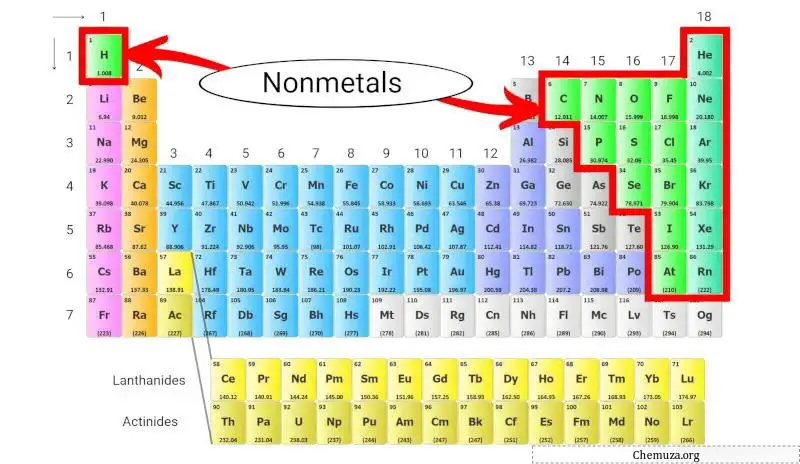
Les non-métaux sont un groupe d’éléments qui n’ont pas les propriétés des métaux, telles qu’une conductivité électrique et un éclat élevés. Ces non-métaux sont situés sur le côté droit du tableau périodique , à l’exception de l’hydrogène .
Les non-métaux peuvent être trouvés sous diverses formes, notamment des gaz comme l’oxygène et le chlore , des liquides comme le brome et des solides comme le soufre et le carbone . [1]
Voyons des choses plus importantes sur les non-métaux.
Que sont exactement les non-métaux ?
Les non-métaux sont des éléments qui ont tendance à gagner des électrons lors de réactions chimiques, formant ainsi des ions ou des anions chargés négativement.
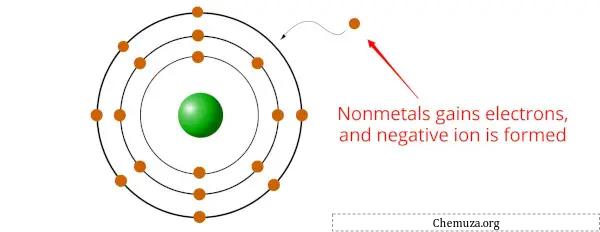
En effet, les non-métaux ont généralement une électronégativité plus élevée que les métaux, [2] ce qui signifie qu’ils ont une plus grande attraction pour les électrons.
Lorsque des non-métaux se lient à des métaux , l’élément non métallique gagne un ou plusieurs électrons du métal pour former un composé stable.
Par exemple, le chlore gagne un électron du sodium pour former le composé ionique chlorure de sodium (NaCl).
On peut aussi dire que – Les non-métaux sont un groupe d’éléments chimiques qui n’ont pas les propriétés physiques et chimiques des métaux.
Eh bien, voyons la liste des non-métaux présents dans le tableau périodique.
Liste des non-métaux présents dans le tableau périodique
Voici une liste des non-métaux présents dans le tableau périodique :
- Hydrogène (H)
- Hélium (Il)
- Carbone (C)
- Azote (N)
- Oxygène (O)
- Fluor (F)
- Néon (Ne)
- Phosphore (P)
- Soufre (S)
- Chlore (Cl)
- Argon (Ar)
- Sélénium (Se)
- Brome (Br)
- Krypton (Kr)
- Iode (I)
- Xénon (Xe)
- Astate (At)
- Radon (Rn)
Ces non-métaux sont situés sur le côté droit du tableau périodique, à l’exception de l’hydrogène, qui est situé en haut du tableau périodique au-dessus des métaux alcalins .
Etat des non métaux (solides, liquides ou gazeux ?)
Les non-métaux peuvent exister dans les trois états de la matière : solide, liquide et gazeux.
L’état d’un non-métal dépend des conditions de température et de pression auxquelles il est exposé.
Parmi tous les non-métaux du tableau périodique ;
- 11 non-métaux sont à l’état gazeux à température ambiante. [3]
- Le brome (Br) est un non-métal qui se trouve à l’état liquide à température ambiante.
- Le reste des non-métaux sont des solides à température ambiante.
Non-métal le plus réactif
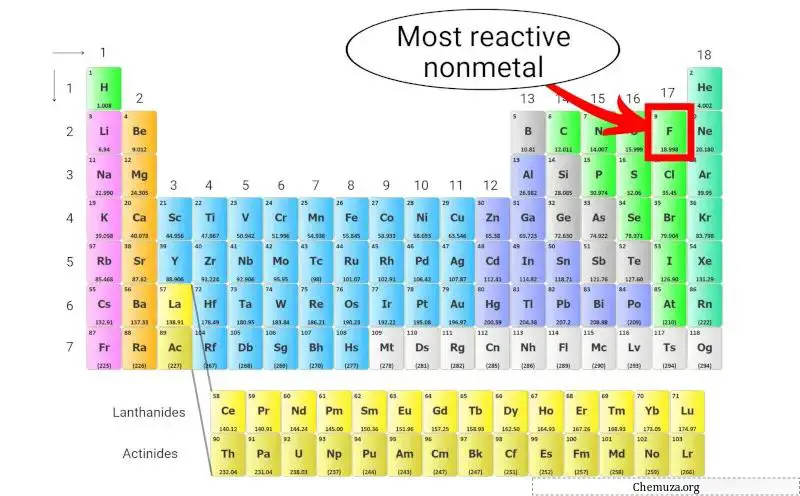
Le fluor (F) est le non-métal le plus réactif présent dans le tableau périodique.
Mais pourquoi? Quelle est la raison pour laquelle le fluor est le plus réactif ?
En effet, il possède l’électronégativité la plus élevée de tous les éléments, ce qui signifie qu’il exerce une forte attraction pour les électrons.
Le fluor possède sept électrons dans son niveau d’énergie le plus externe et nécessite un électron supplémentaire pour remplir sa couche de valence et atteindre une configuration stable.
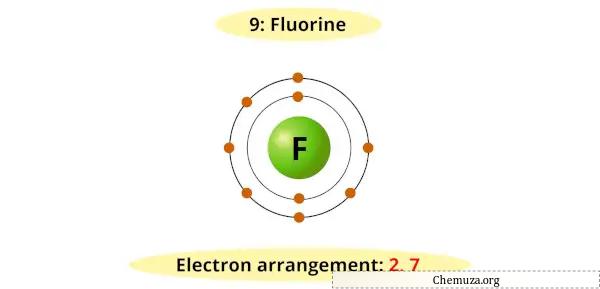
Par conséquent, il accepte facilement un électron provenant d’autres éléments pour former un ion fluorure (F-).
En raison de sa grande réactivité, le fluor peut réagir de manière explosive avec de nombreux autres éléments et composés, notamment l’eau, les métaux et même le verre. [4]
Le fluor est si réactif qu’il est généralement stocké et transporté dans des conteneurs spécialisés fabriqués dans des matériaux résistants à ses propriétés corrosives.
Rôle des non-métaux dans les applications environnementales et industrielles
Les non-métaux sont utilisés dans divers processus industriels et applications environnementales en raison de leurs propriétés uniques. Voici quelques exemples:
- Contrôle de la pollution atmosphérique : Les non-métaux tels que l’azote et l’oxygène jouent un rôle essentiel dans le contrôle de la pollution atmosphérique. Les oxydes d’azote (NOx) sont des polluants nocifs rejetés par les véhicules et les processus industriels. Des catalyseurs non métalliques sont utilisés pour convertir les NOx en gaz inoffensifs comme l’azote et l’eau. De même, l’oxygène est utilisé dans les processus de combustion pour réduire les émissions nocives.
- Engrais : L’azote, le phosphore et le soufre sont des nutriments essentiels à la croissance des plantes. Les engrais non métalliques comme le nitrate d’ammonium et le superphosphate sont largement utilisés en agriculture pour augmenter les rendements des cultures.
- Batteries : des éléments non métalliques tels que le soufre, le carbone et le lithium sont utilisés dans les batteries. Les batteries lithium-ion sont couramment utilisées dans les appareils électroniques, les véhicules électriques et les systèmes d’énergie renouvelable.
- Purification de l’eau : les non-métaux comme le chlore et l’iode sont couramment utilisés comme désinfectants dans les systèmes de purification de l’eau. Ils tuent les bactéries et virus nocifs et rendent l’eau propre à la consommation. [5]
- Fabrication de produits chimiques : les non-métaux tels que le soufre et le chlore sont largement utilisés dans la production de produits chimiques comme l’acide sulfurique, l’acide chlorhydrique et les solvants à base de chlore.
Résumé
Les non-métaux n’ont pas les propriétés des métaux telles qu’une conductivité électrique élevée et un éclat et sont situés sur le côté droit du tableau périodique, à l’exception de l’hydrogène. Ils existent dans les trois états de la matière en fonction des conditions de température et de pression.
Le fluor est le non-métal le plus réactif en raison de sa forte électronégativité et accepte facilement un électron provenant d’autres éléments pour former un ion fluorure (F-).
Les non-métaux ont plusieurs utilisations dans des applications environnementales et industrielles, notamment le contrôle de la pollution atmosphérique, les engrais, les batteries, la purification de l’eau et la fabrication de produits chimiques.
