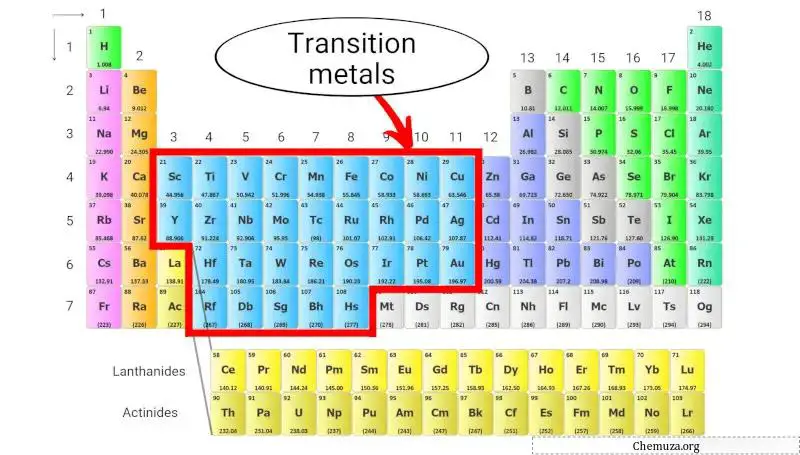
Les métaux de transition sont un groupe d’éléments métalliques trouvés au milieu du tableau périodique , plus précisément du groupe 3 à 11. [1]
Ils ont également des orbitales D partiellement remplies, ce qui leur permet de former facilement des composés complexes et de présenter une large gamme d’ états d’oxydation .
Explorons davantage les métaux de transition du tableau périodique.
Que sont les métaux de transition ?
Les éléments de transition (ou métaux de transition) sont les éléments qui ont des orbitales d partiellement remplies, soit sous leur forme élémentaire (M), soit dans leurs états d’oxydation les plus courants ( M + , M 2+ , M 3+ , etc ).
Permettez-moi d’expliquer cela avec des mots simples accompagnés d’exemples.
Tout d’abord, l’état élémentaire est comme ceci : M ;
Et l’état d’oxydation le plus courant peut être comme ceci : M + , M 2+ , M 3+ , etc.
Exemple 1 : Cuivre
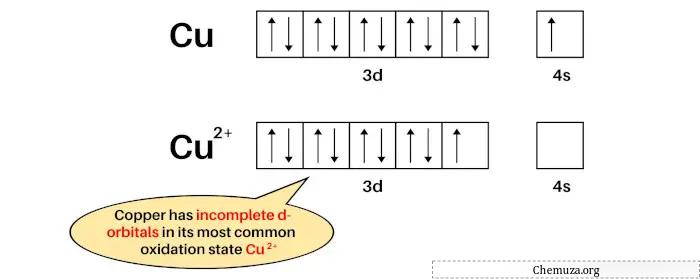
La configuration électronique de Cu est : [Ar] 3d 10 4s 1 et
La configuration électronique de Cu 2+ est : [Ar] 3d 9 .
Le cuivre est un métal de transition car dans son état d’oxydation le plus courant (Cu 2+ ), il possède des orbitales D partiellement remplies.
Exemple 2 : Zinc
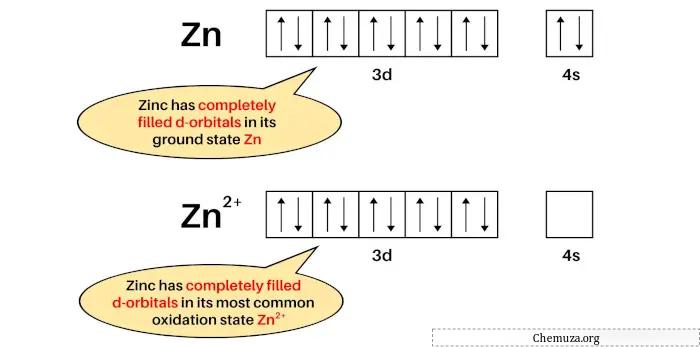
La configuration électronique de Zn est : [Ar] 3d 10 4s 2 et
La configuration électronique de Zn 2+ est : [Ar] 3d 10 .
Le zinc n’est pas un métal de transition car son état fondamental (Zn) et son état d’oxydation le plus courant (Zn 2+ ) ont des orbitales D complètement remplies.
Pourquoi les métaux de transition sont-ils appelés ainsi ?
Les métaux de transition sont appelés ainsi parce que leurs propriétés reflètent une transition de leur nature métallique à non métallique lorsque vous vous déplacez de gauche à droite dans le tableau périodique.
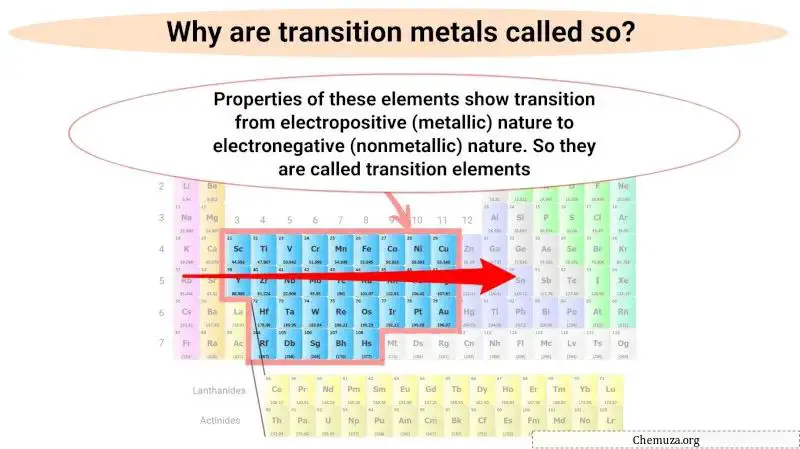
Cette transition progressive du comportement métallique au comportement non métallique est due au changement de configuration électronique des éléments lorsque vous vous déplacez de gauche à droite à travers le bloc.
Les orbitales d jouent un rôle clé dans cette transition, car elles peuvent participer à la liaison chimique de diverses manières, conduisant à la formation d’ions et de composés complexes.
Faits sur les métaux de transition
Voici quelques faits sur les métaux de transition.
- Les métaux de transition sont situés au centre du tableau périodique, ce qui reflète leurs propriétés électroniques et chimiques uniques.
- Certains métaux de transition ont plusieurs états d’oxydation , ce qui signifie qu’ils peuvent former des ions avec des charges différentes selon les conditions de réaction.
- Certains métaux de transition sont d’excellents conducteurs de chaleur et d’électricité, ce qui les rend importants dans de nombreuses applications industrielles.
- Les métaux de transition ont une large gamme d’états d’oxydation, leur permettant de former une variété de composés ayant des propriétés chimiques différentes.
- Les métaux de transition comprennent certains des métaux les plus précieux, tels que l’or , l’argent et le platine , qui ont des applications importantes dans les bijoux, les devises et l’industrie.
Utilisations des métaux de transition
Voici les utilisations de quelques métaux de transition.
- Le fer est utilisé pour fabriquer de l’acier, qui est utilisé dans la construction, les transports et dans de nombreuses autres industries.
- Le cuivre est utilisé dans le câblage électrique, la plomberie et d’autres applications nécessitant une bonne conductivité.
- Le titane est utilisé dans les applications aérospatiales et militaires, ainsi que dans les implants médicaux, en raison de sa solidité, de sa légèreté et de sa résistance à la corrosion.
- Le nickel est utilisé dans l’acier inoxydable et d’autres alliages, ainsi que dans les batteries et la galvanoplastie.
- L’argent est utilisé dans les bijoux, les pièces de monnaie et autres objets décoratifs, ainsi que dans l’électronique, les panneaux solaires et les produits antibactériens.
- L’or est utilisé dans les bijoux, la monnaie et d’autres objets décoratifs, ainsi que dans l’électronique, l’aérospatiale et la médecine.
- Le platine est utilisé dans les pots catalytiques , les bijoux et d’autres applications industrielles en raison de sa résistance à la corrosion et de sa capacité à catalyser les réactions.
- Le manganèse est utilisé dans la fabrication de l’acier, dans les batteries et dans d’autres applications nécessitant des métaux solides et légers.
- Le cobalt est utilisé dans les aimants , les batteries et d’autres applications nécessitant des matériaux solides et durables.
Résumé
Les métaux de transition sont un groupe d’éléments métalliques trouvés au milieu du tableau périodique avec des orbitales D partiellement remplies qui leur permettent de former facilement des composés complexes et de présenter une large gamme d’états d’oxydation.
Leurs propriétés reflètent une transition dans leur nature de métallique à non métallique lorsque vous vous déplacez de gauche à droite dans le tableau périodique. Certains métaux de transition ont plusieurs états d’oxydation et sont d’excellents conducteurs de chaleur et d’électricité.
Ils comprennent des métaux précieux et précieux tels que l’or, l’argent et le platine. Les métaux de transition sont utilisés dans diverses applications telles que la construction, les transports, le câblage électrique, la plomberie, l’aérospatiale, la médecine et les convertisseurs catalytiques industriels.
