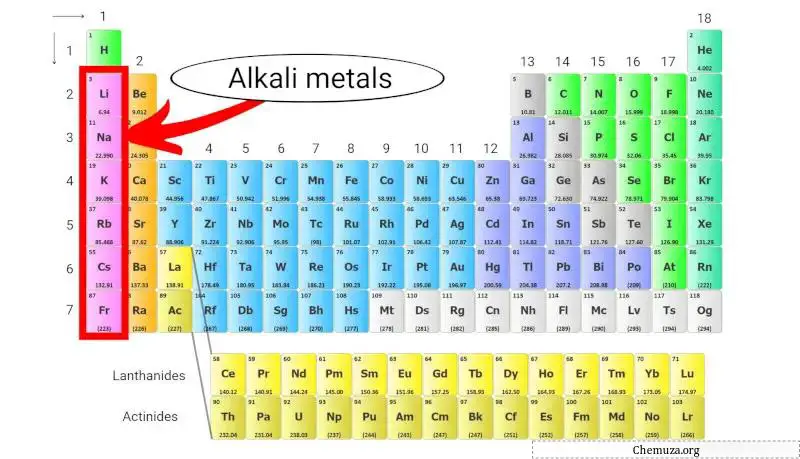
Les métaux alcalins sont un groupe d’éléments chimiques situés dans la première colonne du tableau périodique . Ce groupe comprend le lithium , le sodium , le potassium , le rubidium , le césium et le francium .
Les métaux alcalins sont mous et ont des points de fusion et d’ébullition bas. Ils sont couramment utilisés dans les batteries, les alliages et diverses réactions chimiques.
Explorons davantage les métaux alcalins du tableau périodique.
Que sont les métaux alcalins ?

Les métaux alcalins sont un groupe d’éléments chimiques du tableau périodique qui appartiennent au groupe 1 .
Ces éléments sont connus pour leur douceur, leurs points de fusion bas, leur réactivité élevée et leur capacité à former des solutions alcalines lorsqu’ils réagissent avec l’eau.
Certaines des propriétés clés des métaux alcalins comprennent :
- Ils ont de faibles électronégativités et énergies d’ionisation, ce qui signifie qu’ils ont tendance à perdre facilement des électrons et à former des cations.
- Ils ont des points de fusion et d’ébullition bas, ce qui les rend relativement mous et faciles à fondre.
- Ils ont une réactivité élevée avec l’eau et l’oxygène, ce qui les rend réactifs dans l’air et l’eau.
- Ce sont de bons conducteurs de chaleur et d’électricité.
Pourquoi les métaux alcalins sont-ils appelés ainsi ?

Les métaux alcalins sont appelés ainsi parce qu’ils sont capables de former des solutions fortement alcalines (basiques) lorsqu’ils réagissent avec l’eau. [1]
Lorsque ces métaux entrent en contact avec l’eau, ils libèrent de l’hydrogène gazeux et forment des ions hydroxyde, qui confèrent à la solution un pH basique .
Explication:
La réactivité des métaux alcalins avec l’eau est due à leurs faibles énergies d’ionisation [2] , ce qui signifie qu’ils sont capables de perdre facilement des électrons et de former des ions positifs (cations).
Lorsqu’ils entrent en contact avec l’eau, ils subissent une réaction chimique au cours de laquelle ils perdent des électrons et réagissent avec les molécules d’eau pour former des ions hydroxyde et de l’hydrogène gazeux.
Cette réaction libère beaucoup de chaleur, ce qui peut provoquer l’inflammation et l’explosion de l’hydrogène gazeux.
Ordre de réactivité des métaux alcalins
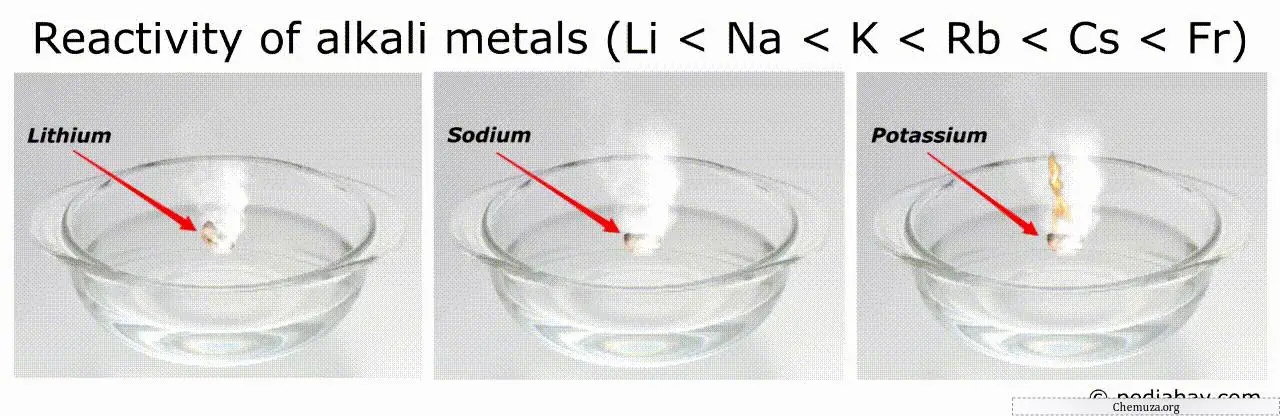
La tendance générale de l’ordre de réactivité des métaux alcalins est qu’il augmente à mesure que l’on descend du groupe du lithium (Li) au francium (Fr).
Cela signifie que le francium est le plus réactif de tous les métaux alcalins, tandis que le lithium est le moins réactif.
La raison de cette tendance est que, à mesure que l’on descend dans le groupe, le rayon atomique des éléments augmente, tandis que l’énergie d’ionisation diminue.
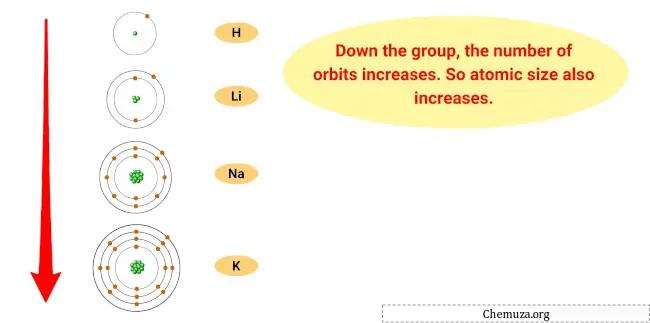
Cela signifie que l’électron le plus externe des atomes est plus éloigné du noyau et tenu moins étroitement, ce qui permet à l’élément de perdre plus facilement cet électron et de devenir un cation.
Le francium, étant le plus grand et le moins étroitement lié du groupe, est donc le plus réactif.
Cet ordre de réactivité a des implications importantes sur les propriétés et le comportement des métaux alcalins.
Par exemple, les métaux les plus réactifs (comme le francium et le césium) peuvent s’enflammer spontanément dans l’air ou dans l’eau, ce qui les rend très dangereux à manipuler.[3]
A l’inverse, les métaux les moins réactifs (comme le lithium) sont plus stables et peuvent être utilisés dans des applications nécessitant un métal plus stable.
Liste des métaux alcalins et leurs configurations électroniques
Les métaux alcalins et leurs configurations électroniques sont indiqués ci-dessous.
| Élément | Configuration électronique |
| Lithium (Li) | [Il] 2s 1 |
| Sodium (Na) | [Ne] 3s 1 |
| Potassium (K) | [Ar] 4s 1 |
| Rubidium (Rb) | [Kr] 5s 1 |
| Césium (Cs) | [Xe] 6s 1 |
| Francium (Fr) | [Rn] 7s 1 |
Tendances périodiques des métaux alcalins
Les tendances périodiques des métaux alcalins sont mentionnées ci-dessous :
- Tendance de valence : la valence des métaux alcalins est toujours de +1, ce qui signifie qu’ils ont tendance à perdre un électron pour former un cation stable. Il n’y a donc aucun changement dans la valence des métaux alcalins à mesure que l’on descend dans le groupe. Ils ont tous la même valence (c’est-à-dire 1).
- Tendance de la taille atomique : La taille atomique des métaux alcalins augmente à mesure que vous descendez dans le groupe, ce qui signifie que les atomes deviennent plus gros. En effet, à mesure que vous ajoutez des niveaux d’énergie, la taille du nuage électronique augmente.
- Tendance du caractère métallique : Le caractère métallique des métaux alcalins augmente à mesure que vous descendez dans le groupe. En effet, les métaux deviennent plus électropositifs et sont plus capables de donner des électrons pour former des liaisons métalliques.
- Tendance de l’électronégativité : L’électronégativité des métaux alcalins diminue à mesure que vous descendez dans le groupe. En effet, les atomes deviennent plus gros et les électrons externes sont plus éloignés du noyau, ils sont donc moins attirés par celui-ci.
- Tendance de l’affinité électronique : L’affinité électronique des métaux alcalins diminue à mesure que vous descendez dans le groupe. En effet, en bas du groupe, la taille des atomes augmente, ce qui diminue la tendance d’un atome à accepter l’électron. (En savoir plus sur la tendance de l’affinité électronique ici, pour une compréhension détaillée).
- Tendance de l’énergie d’ionisation : L’énergie d’ionisation des métaux alcalins diminue à mesure que vous descendez dans le groupe. Cela signifie qu’il est plus facile de retirer un électron de la couche la plus externe de l’atome, car les électrons sont plus éloignés du noyau et sont moins étroitement retenus.
Résumé
Les métaux alcalins sont un groupe d’éléments chimiques connus pour leur douceur, leur faible point de fusion, leur réactivité élevée et leur capacité à former des solutions alcalines lorsqu’ils réagissent avec l’eau.
L’ordre de réactivité des métaux alcalins augmente à mesure que vous descendez du groupe du lithium au francium en raison de l’augmentation du rayon atomique et de la diminution de l’énergie d’ionisation.
Les tendances périodiques des métaux alcalins incluent une augmentation de la taille atomique et du caractère métallique à mesure que l’on descend dans le groupe, ainsi qu’une diminution de l’électronégativité, de l’affinité électronique et de l’énergie d’ionisation.
La valence des métaux alcalins est toujours +1 et leurs configurations électroniques suivent un modèle de [gaz rares] ns 1 .
