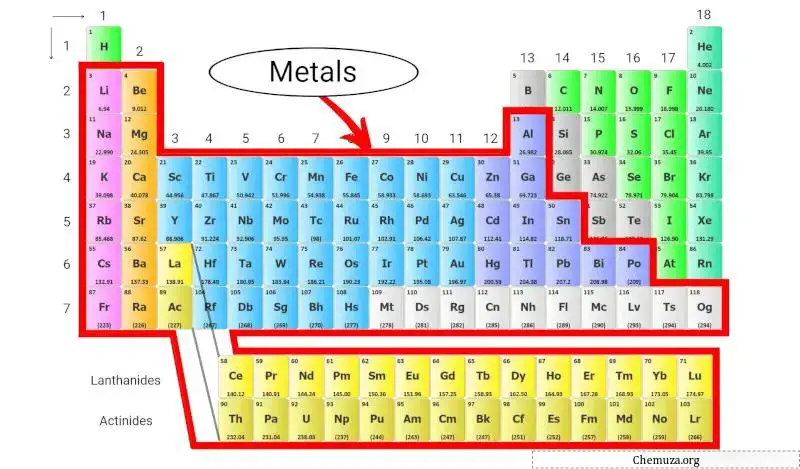
Les métaux du tableau périodique sont des éléments importants que l’on retrouve tout autour de nous, depuis les pièces de monnaie dans nos poches jusqu’aux fils qui alimentent nos maisons. En fait, la plupart des éléments du tableau périodique sont des métaux !
Ils partagent certaines propriétés communes, comme être brillants, bons conducteurs de chaleur et d’électricité et malléables (ce qui signifie qu’ils peuvent être pliés ou façonnés sans se casser). [1]
Explorons davantage les métaux et les différents types de métaux présents dans le tableau périodique.
Quels sont exactement les métaux ?
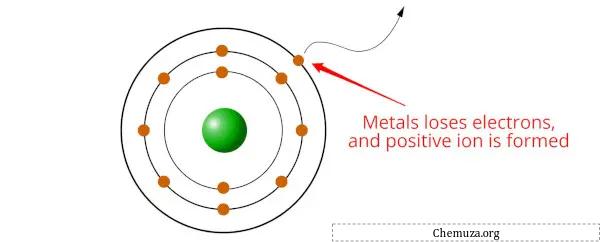
Les métaux sont des éléments qui ont tendance à perdre des électrons et à former des cations (ions chargés positivement) lorsqu’ils subissent des réactions chimiques.
Mais savez-vous pourquoi cela arrive ?
En effet, les métaux ont de faibles énergies d’ionisation, ce qui signifie qu’il faut relativement peu d’énergie pour retirer un électron d’un atome métallique. Lorsqu’un atome de métal perd un ou plusieurs électrons, il devient un cation qui a une charge positive.
Les métaux ont tendance à perdre des électrons afin d’obtenir une configuration électronique plus stable, généralement en obtenant un octet stable (c’est-à-dire 8 électrons dans la couche la plus externe).
Voyons maintenant les différents types de métaux classés dans le tableau périodique.
Métaux alcalins
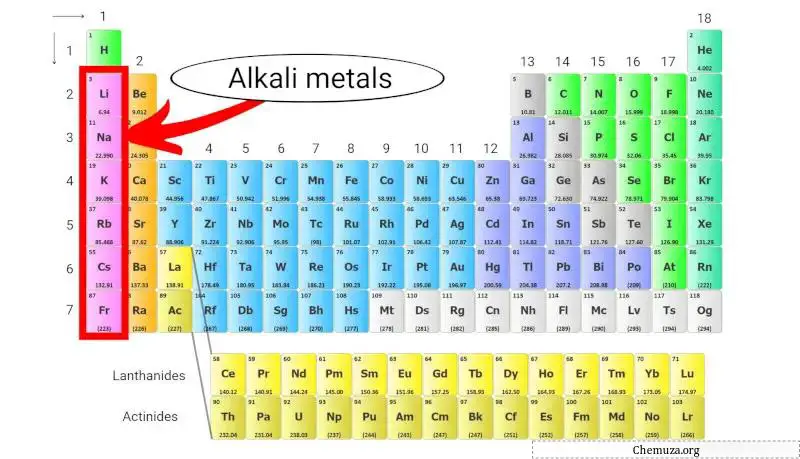
Les métaux alcalins sont un groupe d’éléments du tableau périodique composé du lithium (Li), du sodium (Na), du potassium (K), du rubidium (Rb), du césium (Cs) et du francium (Fr).
Ils appartiennent au groupe 1 du tableau périodique, également connu sous le nom de « groupe des métaux alcalins ».
Les métaux alcalins sont très réactifs en raison de leurs faibles énergies d’ionisation, ce qui les rend plus susceptibles de perdre leur électron de valence unique pour former un cation avec une charge +1. [2]
En savoir plus sur : Métaux alcalins du tableau périodique .
Métaux alcalino-terreux
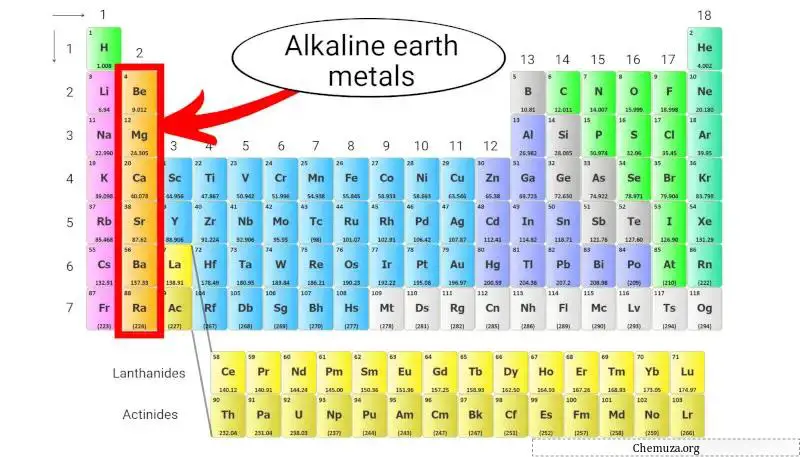
Les métaux alcalino-terreux sont un groupe d’éléments du tableau périodique composé du béryllium (Be), du magnésium (Mg), du calcium (Ca), du strontium (Sr), du baryum (Ba) et du radium (Ra).
Ils appartiennent au groupe 2 du tableau périodique, également connu sous le nom de « groupe des métaux alcalino-terreux ».
Les métaux alcalino-terreux sont moins réactifs que les métaux alcalins, mais ils ont néanmoins des énergies d’ionisation relativement faibles et ont tendance à former des cations avec une charge +2. [3]
En savoir plus sur : Métaux alcalino-terreux du tableau périodique .
Métaux de transition
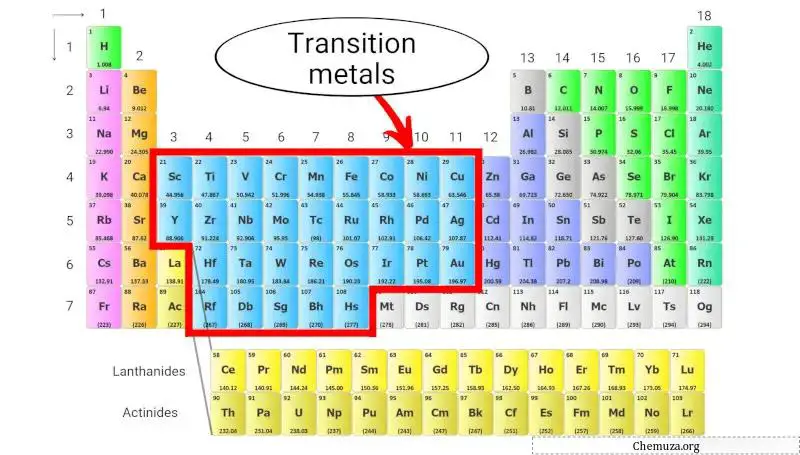
Les métaux de transition sont un groupe d’éléments métalliques situés au centre du tableau périodique, occupant les groupes 3 à 11 (voir l’image ci-dessus).
Ils se caractérisent par leur capacité à former des composés colorés, leurs multiples états d’oxydation et leurs densités et points de fusion relativement élevés.
Les métaux de transition sont connus pour leur réactivité chimique, nombre d’entre eux étant utilisés comme catalyseurs dans des réactions chimiques. Ils sont également utilisés dans diverses applications, telles que la production d’acier et d’autres alliages, l’électronique et les batteries.
En savoir plus sur : Métaux de transition du tableau périodique .
Métaux de transition internes
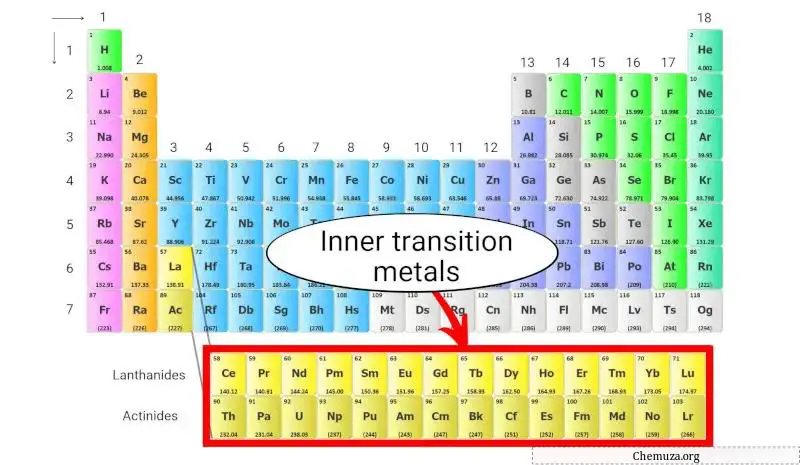
Les métaux de transition interne sont un groupe d’éléments métalliques situés au bas du tableau périodique, sous le corps principal du tableau.
Ils sont divisés en deux sous-groupes :
- Lanthanides et
- Actinides.
La configuration électronique des métaux de transition internes est unique, avec des électrons remplissant les orbitales f de leurs atomes. Cela se traduit par des propriétés électroniques et magnétiques distinctives, ce qui les rend très utiles dans diverses applications technologiques.
En savoir plus sur : Métaux de transition internes du tableau périodique .
Métaux des terres rares
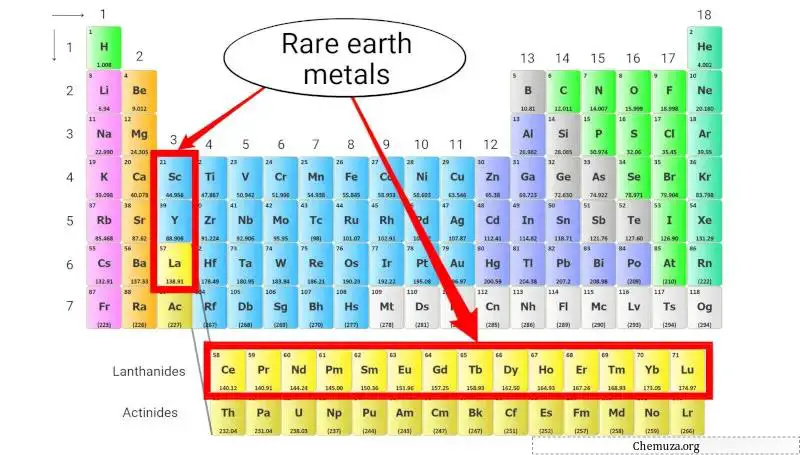
Les métaux des terres rares, également connus sous le nom d’éléments des terres rares, sont un groupe d’éléments métalliques qui comprennent la série des lanthanides (numéros atomiques 57 à 71), le scandium (Sc) et l’yttrium (Y).
Malgré leur nom, les métaux des terres rares ne sont pas réellement rares, mais ils sont difficiles et coûteux à extraire des minerais en raison de leurs faibles concentrations et de leurs similitudes chimiques. [4]
Métaux lourds
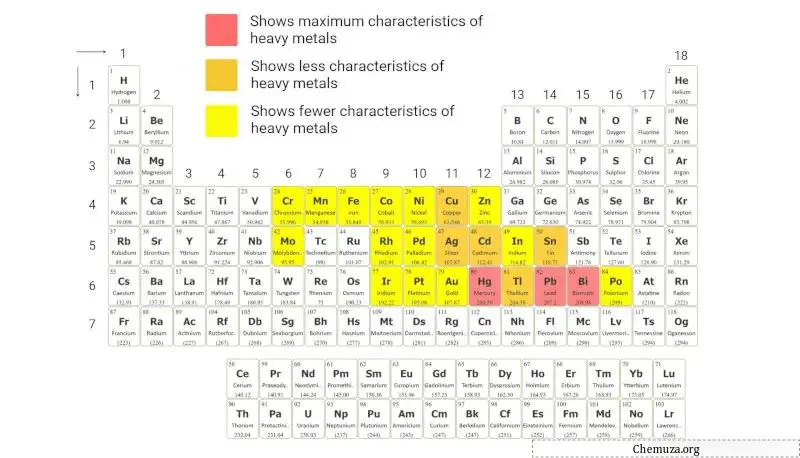
Les métaux lourds sont un groupe d’éléments métalliques qui ont une masse atomique et une densité relativement élevées.
Les métaux lourds sont communément identifiés par le critère de leur densité élevée, généralement supérieure à 5 g/cm³ .
Le tableau périodique ci-dessus fournit une représentation visuelle de ces éléments basée sur cette classification.
En savoir plus sur : Métaux lourds du tableau périodique .
Résumé
Les métaux sont des éléments qui ont tendance à perdre des électrons et à former des cations lorsqu’ils subissent des réactions chimiques. Ils ont de faibles énergies d’ionisation, ce qui les rend plus susceptibles de perdre des électrons et de devenir des ions chargés positivement.
Le tableau périodique contient plusieurs types de métaux, notamment les métaux alcalins, les métaux alcalino-terreux, les métaux de transition, les métaux de transition internes, les métaux des terres rares et les métaux lourds.
Les métaux alcalins sont très réactifs, tandis que les métaux alcalino-terreux sont moins réactifs. Les métaux de transition sont connus pour leur capacité à former des composés colorés et de multiples états d’oxydation, et les métaux de transition internes possèdent des propriétés électroniques et magnétiques uniques. Les métaux des terres rares sont difficiles et coûteux à extraire, tandis que les métaux lourds ont des densités élevées.
