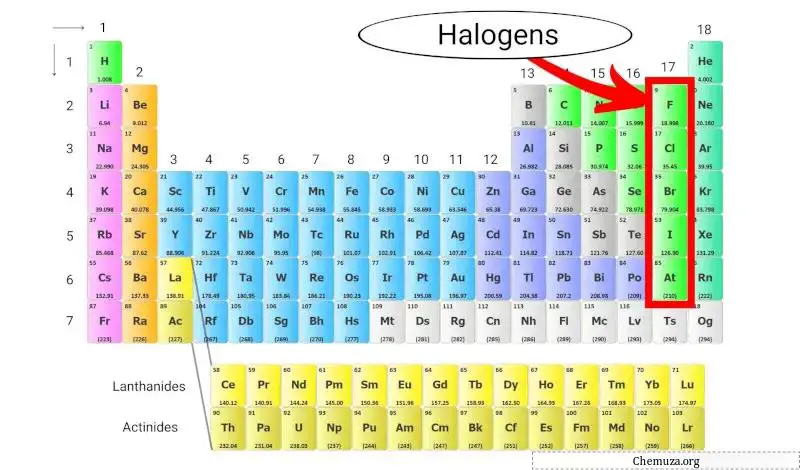
Les halogènes sont un groupe d’éléments qui se trouvent dans le groupe 17 (également appelé groupe halogène) du tableau périodique . Les halogènes comprennent cinq éléments différents : le fluor (F), le chlore (Cl), le brome (Br), l’iode (I) et l’astatine (At).
Les halogènes sont uniques car ils constituent le seul groupe d’éléments capables de former des composés avec tous les autres éléments du tableau périodique.
Explorons davantage les halogènes.
Que sont les halogènes ? Et pourquoi sont-ils appelés ainsi ?
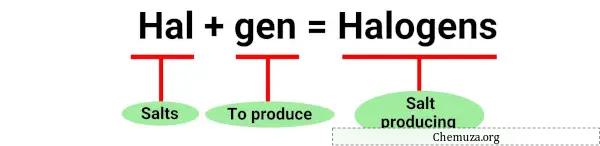
Le terme « halogène » est dérivé des mots grecs « halos » signifiant sel et « gènes » signifiant producteur. [1]
En effet, les halogènes ont été découverts pour la première fois grâce à leur capacité à produire des sels lorsqu’ils réagissaient avec des métaux .
Par exemple:
Lorsque le chlore (Cl 2 ) réagit avec le sodium (Na), il forme du chlorure de sodium (NaCl), qui est un sel de table courant :
2Na + Cl2 → 2NaCl
De même, lorsque le brome (Br 2 ) réagit avec le potassium (K), il forme du bromure de potassium (KBr) :
2K + Br2 → 2KBr
Ces réactions sont des exemples d’halogènes produisant des sels lorsqu’ils réagissent avec des métaux, d’où le nom « halogène ».
L’halogène le plus réactif du tableau périodique
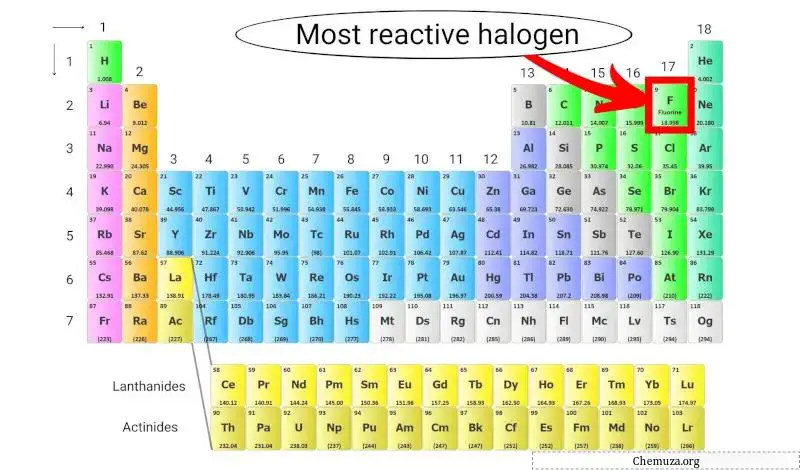
Le fluor est l’halogène le plus réactif car il possède l’ électronégativité la plus élevée de tous les éléments du tableau périodique, ce qui signifie qu’il exerce une forte attraction pour les électrons.
Cela le rend très réactif et capable de réagir avec presque tous les autres éléments du tableau périodique pour former des composés. [2]
En termes simples, le fluor est comme un aimant pour les électrons et il fera tout ce qu’il peut pour gagner un électron et compléter sa coque externe.
Pour ce faire, il réagit avec d’autres éléments et vole leurs électrons pour former de nouveaux composés.
C’est pourquoi le fluor est si réactif et pourquoi on ne le trouve jamais sous sa forme élémentaire dans la nature, mais existe toujours sous forme d’un composé.
En raison de sa grande réactivité, le fluor est également extrêmement dangereux et peut être dangereux à utiliser.
Il est souvent manipulé dans des laboratoires spécialisés et est utilisé dans des processus industriels pour produire une large gamme de produits chimiques et de matériaux.
Réactivité des halogènes
Les halogènes sont très réactifs en raison de leur électronégativité plus élevée, ce qui signifie qu’ils ont une très grande capacité à attirer les électrons.
De plus, les halogènes ont 7 électrons dans leur couche la plus externe, et ils n’ont besoin que d’un électron supplémentaire pour la remplir et atteindre une configuration électronique stable comme les gaz rares .
Par exemple, vous pouvez voir que le diagramme de Bohr du fluor possède 7 électrons dans sa couche la plus externe.
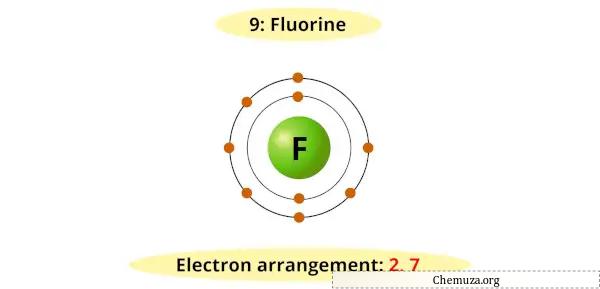
Il faut désormais 1 électron supplémentaire pour obtenir un octet stable (7 + 1 = 8).
Les halogènes réagissent avec les métaux pour former des composés ioniques appelés halogénures métalliques , qui peuvent produire des flammes vives et colorées.
Ils réagissent également avec des non-métaux comme l’hydrogène , le soufre et l’azote pour former une gamme de composés covalents. [3]
Par conséquent, la tendance des halogènes à gagner un électron et à obtenir une configuration stable de gaz rares les rend très réactifs et capables de former des composés avec d’autres éléments.
Tendances périodiques des halogènes
À mesure que nous descendons dans le groupe, les éléments halogènes présentent des changements dans leurs propriétés physiques ainsi que dans leurs propriétés chimiques.
Voyons les tendances de quelques propriétés des halogènes.
- Taille atomique : À mesure que l’on descend dans le groupe, la taille atomique des halogènes augmente. En effet, chaque halogène a un niveau d’énergie de plus que celui situé au-dessus, ce qui signifie que les électrons les plus externes sont plus éloignés du noyau.
- Electronégativité : À mesure que l’on descend dans le groupe, l’électronégativité des éléments halogènes diminue. Cela signifie que les halogènes en haut du groupe, comme le fluor et le chlore, sont plus électronégatifs et donc plus susceptibles d’attirer les électrons que ceux en bas, comme l’iode et l’astatine.
- Points de fusion et points d’ébullition : À mesure que l’on descend dans le groupe, les points de fusion et d’ébullition des halogènes augmentent. En effet, les atomes les plus gros possèdent plus d’électrons et sont capables de former des forces intermoléculaires plus fortes. [4]
- Réactivité envers les métaux : Au fur et à mesure que l’on descend dans le groupe, la réactivité des halogènes envers les métaux diminue. Cela signifie que les halogènes en haut du groupe, comme le fluor et le chlore, sont plus susceptibles de réagir avec les métaux que ceux en bas, comme l’iode et l’astatine.
Résumé
Les halogènes sont un groupe de cinq éléments (fluor, chlore, brome, iode et astate) trouvés dans le groupe 17 du tableau périodique. Ils sont uniques dans leur capacité à former des composés avec tous les autres éléments.
Les halogènes sont très réactifs en raison de leur électronégativité élevée et de leur tendance à gagner un électron pour obtenir une configuration stable de gaz rares. Le fluor est l’halogène le plus réactif en raison de sa forte électronégativité.
À mesure que l’on descend dans le groupe, les halogènes présentent des changements dans leurs propriétés physiques et chimiques, tels qu’une augmentation de la taille atomique, une diminution de l’électronégativité et une augmentation des points de fusion et d’ébullition. La réactivité des halogènes envers les métaux diminue également à mesure que l’on descend dans le groupe.
