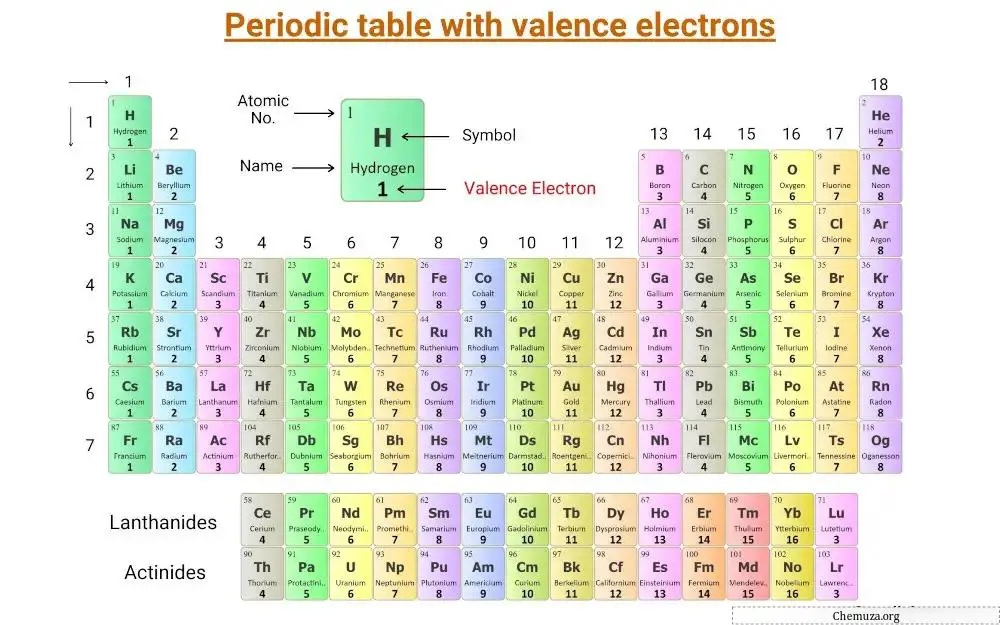
Il s’agit d’un tableau périodique sur lequel sont étiquetés les électrons de valence.
Comprenons le concept d’ électrons de valence ainsi que le nombre d’électrons de valence des éléments du groupe principal et des éléments de transition .
Que sont les électrons de valence ?
Les électrons de Valence sont les électrons situés dans la couche la plus externe ou le niveau d’énergie d’un atome qui sont impliqués dans la liaison chimique.
Par exemple, le magnésium a 2 électrons sur son orbite la plus externe, il a donc 2 électrons de valence. [1]
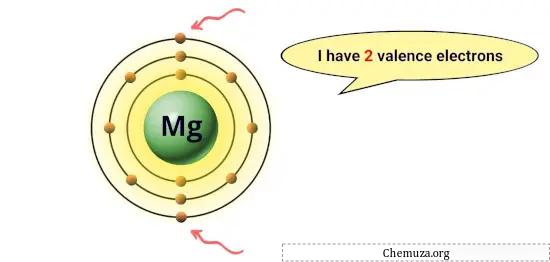
Ces électrons sont responsables des propriétés chimiques d’un élément, telles que sa réactivité et les types de liaisons chimiques qu’il peut former avec d’autres atomes.
Le nombre d’électrons de valence que possède un atome détermine sa position dans le tableau périodique et sa capacité à former des liaisons chimiques .
Électrons de Valence des éléments du groupe principal
Les principaux éléments du groupe, également appelés éléments représentatifs, sont situés dans les groupes 1, 2 et 13 à 18 du tableau périodique.
Le nombre d’électrons de valence dans ces éléments est égal à leur numéro de groupe.
Par exemple, les éléments du groupe 1, comme le lithium et le sodium , ont un électron de valence, tandis que les éléments du groupe 2, comme le magnésium et le calcium , ont deux électrons de valence.
Les éléments du groupe 13, comme le bore et l’aluminium , ont trois électrons de valence, et ainsi de suite.
Ces électrons de valence sont responsables des propriétés chimiques et de la réactivité uniques des éléments.
Électrons de valence des éléments de transition et de transition interne
Les électrons de valence des éléments de transition et des éléments de transition internes sont plus compliqués à déterminer que ceux des éléments du groupe principal.
En effet, la sous-couche d des éléments de transition et la sous-couche f des éléments de transition internes sont incomplètement remplies et sont très proches de la sous-couche s externe.
En conséquence, les électrons des sous-couches d et s dans les éléments de transition et des sous-couches f et s dans les éléments de transition internes peuvent se comporter comme des électrons de valence.
Pour les éléments de transition, les électrons de valence peuvent aller de 3 à 12 en raison de la contribution des électrons de la sous-couche d et de la sous-couche s. Dans certains cas, les électrons des orbitales d incomplètes sont également considérés comme des électrons de valence. [2]
De même, pour les éléments de transition internes (ou éléments du bloc f), les électrons de valence peuvent aller de 3 à 16 en raison de la contribution des électrons de la sous-couche f et de la sous-couche s. [3] Les électrons des orbitales d incomplètes peuvent également être considérés comme des électrons de valence dans certains métaux de transition internes.
Il est important de noter que pour les éléments de transition et de transition interne, les électrons de valence sont les électrons présents dans les coquilles à l’extérieur du noyau de gaz rare.
