Le sulfure de zinc (ZnS) est un composé composé de zinc et de soufre. Il est utilisé dans diverses applications, notamment les matériaux luminescents, l’optoélectronique et les phosphores pour les écrans LED.
| Nom UICPA | Sulfure de zinc |
| Formule moléculaire | ZnS |
| Numero CAS | 1314-98-3 |
| Synonymes | Sphalérite, Blende, Blende de Zinc, Wurtzite |
| InChI | InChI=1S/S.Zn |
Propriétés du sulfure de zinc
Formule de sulfure de zinc
La formule chimique du sulfure de zinc est ZnS, indiquant sa composition en atomes de zinc (Zn) et de soufre (S). Ce composé constitue un élément crucial de diverses applications industrielles et scientifiques en raison de ses propriétés uniques.
Sulfure De Zinc Masse molaire
Le sulfure de zinc a une masse molaire d’environ 97,45 grammes par mole. Cette valeur représente les masses atomiques combinées des atomes de zinc et de soufre constitutifs dans une seule molécule de ZnS.
Point d’ébullition du sulfure de zinc
Le sulfure de zinc ne possède pas de point d’ébullition distinct car il a tendance à se décomposer plutôt que de subir un véritable processus d’ébullition lorsqu’il est chauffé. Cette caractéristique résulte de ses propriétés chimiques.
Point de fusion du sulfure de zinc
Le sulfure de zinc a un point de fusion d’environ 1 850 degrés Celsius (3 362 degrés Fahrenheit). Ce point de fusion élevé le rend adapté à diverses applications à haute température.
Densité du sulfure de zinc g/mL
La densité du sulfure de zinc varie en fonction de sa forme cristalline. Généralement, sa densité est comprise entre 3,98 et 4,09 grammes par centimètre cube (g/cm³). Cette gamme de densité contribue à son utilisation dans les matériaux optiques.
Sulfure de Zinc Poids moléculaire
Le poids moléculaire du sulfure de zinc, calculé en additionnant les masses atomiques de ses composants, est d’environ 97,45 grammes par mole. Cette valeur est cruciale pour déterminer la quantité de ZnS dans un échantillon donné.
Structure du sulfure de zinc
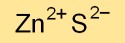
Le sulfure de zinc existe sous différentes structures cristallines, principalement sous forme de blende de zinc cubique (également connue sous le nom de sphalérite) et de wurtzite hexagonale. Ces arrangements d’atomes déterminent ses propriétés physiques et optiques.
Solubilité du sulfure de zinc
Le sulfure de zinc est peu soluble dans l’eau, ce qui le rend pratiquement insoluble. Cette caractéristique est due aux liaisons fortes entre les atomes de zinc et de soufre, entraînant une dissolution limitée dans les solutions aqueuses. Cependant, il peut être dissous dans certains acides ou alcalis dans des conditions spécifiques.
| Apparence | Solide |
| Gravité spécifique | 3,98 – 4,09 g/cm³ |
| Couleur | Blanc, jaune, marron, noir |
| Odeur | Inodore |
| Masse molaire | ~97,45 g/mole |
| Densité | 3,98 – 4,09 g/cm³ |
| Point de fusion | ~1 850 °C (~3 362 °F) |
| Point d’ébullition | Se décompose |
| Point d’éclair | N’est pas applicable |
| Solubilité dans l’eau | Pratiquement insoluble |
| Solubilité | Soluble dans les acides, les alcalis dans des conditions spécifiques |
| Pression de vapeur | Négligeable |
| Densité de vapeur | N’est pas applicable |
| pKa | ~4,7 |
| pH | ~7 (neutre) |
Sécurité et dangers du sulfure de zinc
Le sulfure de zinc présente une faible toxicité aiguë mais peut libérer du dioxyde de soufre toxique lorsqu’il est chauffé. Il est généralement considéré comme sûr dans des conditions normales de manipulation. Cependant, l’inhalation de ses poussières ou de ses vapeurs peut provoquer une irritation respiratoire. Évitez tout contact avec la peau et les yeux. En cas d’exposition, rincer abondamment et consulter un médecin si l’irritation persiste. Un incendie ou une chaleur excessive peut entraîner une décomposition et libérer des gaz dangereux. Conserver à l’écart des matériaux incompatibles. Manipulez avec soin, portez un équipement de protection approprié et travaillez dans des zones bien ventilées pour assurer la sécurité et prévenir les dangers potentiels associés au sulfure de zinc.
| Symboles de danger | Aucun |
| Description de la sécurité | Faible toxicité aiguë ; libère du dioxyde de soufre gazeux toxique lors du chauffage ; manipuler avec soin |
| Numéros d’identification de l’ONU | N’est pas applicable |
| Code SH | 2830.90.10 |
| Classe de danger | Non classé comme dangereux |
| Groupe d’emballage | N’est pas applicable |
| Toxicité | Faible toxicité ; irritation respiratoire due à la poussière ou aux fumées ; manipuler avec précaution |
Méthodes de synthèse du sulfure de zinc
Le sulfure de zinc peut être synthétisé par diverses méthodes. Une approche courante consiste à faire réagir des gaz d’oxyde de zinc (ZnO) et de sulfure d’hydrogène (H2S) à des températures élevées. La réaction se déroule comme suit :
ZnO (s) + H2S (g) → ZnS (s) + H2O (g)
Une autre méthode implique la réaction entre le chlorure de zinc (ZnCl2) et le sulfure d’hydrogène gazeux :
ZnCl2 (aq) + H2S (g) → ZnS (s) + 2 HCl (g)
Alternativement, les nanoparticules de sulfure de zinc peuvent être synthétisées à l’aide de méthodes de précipitation. Cela consiste à mélanger des sels de zinc solubles avec des sels de sulfure solubles dans des conditions contrôlées, conduisant à la formation de nanoparticules de sulfure de zinc. Dans certains cas, des composés organiques sont utilisés comme agents de coiffage pour contrôler la taille et la stabilité des particules.
Le sulfure de zinc peut également être préparé en faisant réagir du zinc métallique avec du soufre élémentaire. Les deux substances sont chauffées ensemble pour initier la réaction :
Zn (s) + S (s) → ZnS (s)
Ces méthodes offrent une polyvalence dans la production de sulfure de zinc aux propriétés variables pour différentes applications, telles que l’optoélectronique, les matériaux luminescents, etc.
Utilisations du sulfure de zinc
Le sulfure de zinc trouve diverses applications dans diverses industries en raison de ses propriétés uniques. Voici ses utilisations notables :
- Revêtements optiques : La transparence du sulfure de zinc dans la région infrarouge en fait un matériau précieux pour les revêtements optiques, les lentilles et les fenêtres des systèmes et capteurs d’imagerie thermique.
- Matériaux luminescents : Il sert de matériau hôte pour créer des composés luminescents, tels que le sulfure de zinc dopé au cuivre pour les applications qui brillent dans le noir.
- Applications des semi-conducteurs : dans les transistors à couches minces et autres dispositifs semi-conducteurs, les films de sulfure de zinc jouent un rôle dans les composants électroniques.
- Phosphores d’affichage LED : les écrans LED utilisent des phosphores de sulfure de zinc pour améliorer la couleur et la luminosité.
- Détection des rayons X et gamma : les détecteurs à scintillation utilisent les propriétés scintillantes du sulfure de zinc pour détecter les rayons X et gamma.
- Pigments et peintures : Les pigments blancs contenus dans les peintures, les revêtements et les encres d’imprimerie utilisent des formes spécifiques de sulfure de zinc telles que le blanc de zinc ou le lithopone.
- Marqueurs fluorescents : dans les applications biologiques, les chercheurs fonctionnalisent les nanoparticules de sulfure de zinc pour les marqueurs fluorescents dans les études d’imagerie.
- Cellules solaires : les scientifiques étudient les nanoparticules de sulfure de zinc pour déterminer leur potentiel à améliorer l’absorption de la lumière dans les cellules solaires photovoltaïques.
- Catalyse : En explorant sa nature semi-conductrice, les chercheurs étudient les propriétés catalytiques du sulfure de zinc dans diverses réactions chimiques.
- Fenêtres infrarouges : les appareils optiques tels que les caméras, les télescopes et les capteurs intègrent du sulfure de zinc pour les fenêtres infrarouges.
La polyvalence du sulfure de zinc découle de sa capacité à présenter une luminescence, une transparence et un comportement semi-conducteur. Ses applications sur mesure contribuent de manière significative à des domaines tels que l’optique, l’électronique, l’énergie et la science des matériaux.
Des questions:
Q : Quelle est la formule du sulfure de zinc ?
R : La formule du sulfure de zinc est ZnS.
Q : Le sulfure de zinc est-il soluble ?
R : Le sulfure de zinc est généralement insoluble dans l’eau.
Q : Le ZnS est-il soluble dans l’eau ?
R : Non, le ZnS n’est pas soluble dans l’eau.
Q : Le sulfure de zinc contient 67,1 % de zinc en masse. Quelle est la fraction massique de soufre dans le sulfure de zinc ?
R : La fraction massique de soufre dans le sulfure de zinc est de 32,9 %.
Q : Comment pourriez-vous séparer le chlorure de zinc du sulfure de zinc ?
R : Le chlorure de zinc et le sulfure de zinc peuvent être séparés en dissolvant le chlorure de zinc dans l’eau, laissant derrière eux le sulfure de zinc insoluble.
Q : Le sulfure de zinc est-il ionique ?
R : Oui, le sulfure de zinc est principalement ionique.
Q : Quel type de défaut stœchiométrique est représenté par le ZnS ?
R : Le sulfure de zinc peut présenter des défauts stœchiométriques de type Frenkel.
Q : Qu’est-ce que le ZnS ?
R : ZnS est la formule chimique du sulfure de zinc, un composé de zinc et de soufre.
Q : Quel est le pH minimum requis pour empêcher la précipitation du ZnS ?
R : Le pH minimum requis pour empêcher la précipitation du ZnS est d’environ 4,7.
Q : Cette image montre la cellule unitaire cubique pour le ZnS. Combien d’ions Zn²⁺ y a-t-il dans cette maille cubique ?
R : Dans la maille cubique du ZnS, il y a quatre ions Zn²⁺.
Q : Le ZnS est-il ionique ou covalent ?
R : Le ZnS est principalement considéré comme ionique.
Q : Quel type de réaction est Zn + S = ZnS ?
R : La réaction Zn + S = ZnS est une réaction de synthèse ou de combinaison.
